Aort disseksiyonu hızlı tanı ve tedavi yaklaşımını gerektiren, sonrasında yoğun izlem ve yakın takibin şart olduğu bir vasküler patoloji. Tedavi ve bakım için bu hastaların kardiyovasküler cerrahi yapılan bir merkeze transferi şart. Dolayısı ile disseksiyondan şüphelenildiği andan itibaren bu hastalara özel yaklaşım gerekli. Daha sonra disseksiyon tanısı konmuş hastalara başlangıçta farklı başka tanı konabildiği de bilinmekte; dolayısı ile ayırıcı tanının hızlı yapılması hayati önem taşıyor. Aort disseksiyonunda tanı ve tedavi CEACCP 2009’un ilk sayısında yer alan konulardan biri. Konuya ilişkin güncel yaklaşımı ele alıp, takip eden yazımızda da anestezistin rolüne değineceğiz.
Aort disseksiyonu nadir görülmekle beraber ölümle sonuçlanabilen bir patolojidir. Aortanın tunika medya tabakasının katmanları ayrışır, içine kanın dolduğu, yukarı ve aşağıya doğru uzanan ikinci bir lümen (yalancı lümen) görünümü ortaya çıkar. Çıkan aort disseksiyonu, en sık görülen tipidir ve abdominal aort rüptüründen 2-3 kat daha sıklıkta görülür. Tedavi edilmemiş çıkan aort disseksiyonunda, ilk 48 saat içinde, geçen her bir saat mortaliteyi %1-2 oranında arttırmaktadır.
Sınıflandırma
Aort disseksiyonunun tanımlanmasında birden çok sınıflama göze çarpmaktadır. Bazı sınıflamalar disseksiyonun anatomisini esas alırken, diğer sınıflamalar olay öncesi semptomların başlangıcından itibaren geçen süreyi esas almaktadır. Semptomların başlangıcından sonra 2 hafta içinde aort disseksiyonu tanısı konulabiliyorsa akut; bu süre 2 haftayı geçmişse kronik aort disseksiyonu olarak tanımlanır. “European Society of Cardiology Task Force on Aortic Dissection” etyolojik bir sınıflama da ortaya koymuştur. Akut aortik sendromlar olarak gruplanan intramural hemoraji, intramural hematom ve aortik ülserlerin gelişmekte olan diseksiyonun belirtileri olabileceği gösterilmiştir.
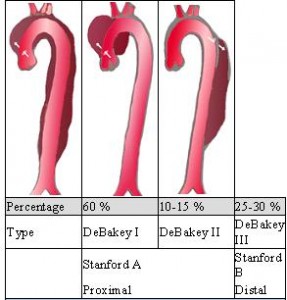
Stanford ve De Bakey anatomik sınıflamalr yapmıştır. En sık kullanılan Stanford sınıflandırmasında aort disseksiyonu lokalizasyonuna göre ikiye ayrılır. Disseksiyon çıkan aortayı tutmuşsa Tip A (De Bakey tip 1 ve 2), sadece inen aortayı tutmuşsa Tip B (De Bakey tip 3), olarak adlendırılırlar. Tip A’da çıkan aorta tutulmuştur; fakat disseksiyon arkus aorta ve inen aortaya kadar uzanabilir. Tip B’de ise disseksiyon daima sol subklavien arterin distalindedir. De Bakey sınıflamasına göre ise Tip 1’de çıkan aorta, arkus aorta ve inen aorta, Tip 2’de sadece çıkan aorta, Tip 3’te sadece inen aorta (sol subklavien arterin distali) tutulur. Stanford sınıflaması bize tedavide de yol gösterir. Tip A disseksiyonlar sıklıkla cerrahi tedavi gerektirirken, Tip B disseksiyonlarda medikal tedavi ile konservatif yaklaşım izlenebilir.
Solda disseksiyon ipleri görülmektedir.
Patofizyoloji
Aort disseksiyonunu erkeklerde daha sıklıkta ve 50-70 yaşları arasında görülür. Aort disseksiyonu, aortada intimal flap varlığı ile karakterizedir. Bunlar çoğunlukla medial duvar dejenerasyonu veya kistik medial nekroz zemininde gelişirler. Aort duvarındaki mekanik stress, intramural basınç ve damar çapı ile doğru orantılıdır. Bu nedenle intimal yırtık, aortanın en çok basınca maruz kaldığı bölgelerde gözükür. Aort disseksiyonu için bilinen risk faktörleri şöyle sıralanmaktadır:
Uzun süreli arteryel hipertansiyon
İleri yaş
Sigara
Dislipidemi
Kokain
Bağ dokusu hastalıkları
Marfan sendromu
Ehlers-Danlos sendromu
Turner sendromu
Herediter vasküler hastalıklar
Biküspid aorta
Aort koarktasyonu
Vaskülitler
Dev hücreli arterit
Takayasu arteriti
Sifiliz
Aort anevrizması
Gebelik
Deselerasyon travması (kaza, yüksekten düşme)
İyatrojenik
Kateterizasyon
Aort cerrahisi
Kanülasyon
Aort disseksiyonlarının çoğu, aort kapağının 10 cm uzağında aortun büyük kurvatürü (aort kavsi) boyunca, transvers yırtık ile kendini gösterir. Disseksiyonun en sık izlendiği diğer yer ise sol subklavien arterin distali, inen aortadır.
Klinik
Aort disseksiyonunun klinik özellikleri iki aşamalıdır. İlk semptom, intimanın yırtılmasına bağlı olarak aniden ortaya çıkan şiddetli göğüs ağrısıdır ve aort disseksiyonunun en karakteristik özelliğidir. Göğüs ağrısı özellikle tip A disseksiyonda görülürken, sırt ağrısı ve abdominal ağrı tip B’de daha sık görülür. Bu ağrı migratuar tarzda olabilir ve disseksiyon hattı boyunca ilerleyebilir. Göğüs ağrısına taşikardi ve hipertansiyon eşlik eder; artmış anksiyete ve ağrıya yanıt olarak ortaya çıkan katekolamin deşarjına bağlıdırlar. İkinci aşamada ise aort duvarındaki basınç artışı kritik noktaya ulaşmış, rüptür meydana gelmiştir ve buna bağlı semptomlar taşikardiye eşlik eden hipotansiyon, perikardiyal tamponad, akut aort kapak yetmezliği veya akut miyokard iskemisi olabilir. Ekstremitelerde nabız alınamayabilir ve aort odağında diyastolik üfürüm duyulabilir. Daha az sıklıkla malperfüzyona bağlı senkop, inme ve diğer nörolojik semptomlar izlenebilir.
TANI
Risk faktörleri olan, 60 yaşında hipertansif hastada ani başlayan şiddetli göğüs ağrısı bize aort disseksiyonunu düşündürmelidir. Tüm hastalarda miyokard enfarktüsünü dışlamak amacıyla öncelikle EKG değerlendirilmelidir. Tip A disseksiyonlu hastaların %20’sinde, disseksiyonun koroner ostiuma kadar yayılımına bağlı, EKG’de iskemik değişiklikler izlenebilir. Miyokardiyal hasarın biyokimyasal belirteçleri tanıda yardımcı olabilir. Bu tip hastalarda trombolitik ve revaskülarizasyon tedavisinden önce ileri tetkik ve araştırmalar yapılmalıdır. Aort disseksiyonu tanısında kullanılan biyokimyasal belirteçlerden en önemlisi düz kas miyozin ağır zincir proteinidir, aortanın medial kas tabakasının hasarlanmasına bağlı olarak seviyesi yükselir.
Görüntüleme Yöntemleri
Aort disseksiyonu tanısında bilgisayarlı tomografi (BT), magnetik rezonans (MR) ve ekokardiyografi gibi çeşitli modaliteler kullanılmaktadır. Düz toraks grafisinde aort topuzunda değişiklikler ve duvardan 6 mm’den fazla ayrılmış intima kalsifikasyonu, genişlemiş mediastinum, kardiyomegali (perikardiyal effüzyon), hemotoraksa bağlı kapalı kostofrenik sinüsler görülebilir. Aortografi ile gerçek ve yalancı lümen ayırtedilebilir; fakat aort disseksiyonu tanısında eskiden altın standart olmasına rağmen, anstabil hastada kullanımının güvenli olmaması ve invazif bir işlem olması nedeniyle günümüzde popülaritesini kaybetmektedir. BT ve MR hızlı ve non-invazif olmaları nedeniyle tercih edilirlerken, hemodinamik açıdan anstabil hastalarda önerilmezler. Transtorasik ekokardiyografi (TTE), kolay ulaşılabilir olması, çıkan aorta ve aortik arkusu iyi bir şekilde görüntüleyebilmesi nedeniyle önemi giderek artmaktadır. Ancak obezlerde ve toraks travmalı hastalarda görüntü kalitesi kötü olabilir. Transösofageal ekokardiyografi (TÖE) yaygınlaştıkça popülaritesi artmış bir görüntüleme yöntemidir. Hemodinamik açıdan anstabil hastalarda perioperatif olarak kullanımı uygundur. Çıkan aortanın distali ile trakea veya sağ ana bronşun kapattığı arkusun bir bölümü dışında tüm torasik aortayı görüntülememizi sağlar. İntravasküler ultrason kateter aracılıklı bir görüntüleme yöntemidir; aortik duvar ve intima flapinin dinamik görüntülenmesini sağlar.
TEDAVİ
Akut tip A ve komplike tip B aort disseksiyonu olan hastalar, yoğun bakımı olan ve acil cerrahi girişim imkanı sağlayabilen kardiyotorasik cerrahi merkezlerinde cerrahi yolla tedavi edilmelidirler. Başlangıç tedavisi klinik duruma göre yapılır. Ağrı mutlaka giderilmelidir. Bu hastalarda ilk hedefimiz perfüzyonu bozmadan sol ventrikül kontraksiyonunu azaltmaktır. Böylelikle disseksiyonun ileriye yayılımı ve olası bir rüptür önlenmeye çalışılır. Bu amaçla beta-blokerler, labetalol (beta+alfa bloker), tansiyonda daha fazla düşme gerekiyorsa sodyum nitroprussid, gliseriltrinitrat ve hidralazin kullanılabilir. Beta-blokerler, vazodilatatörlerden önce, ilk tercih olarak düşünülmelidirler; çünkü vazodilatasyona bağlı refleks katekolamin deşarjı, sol ventrikül kontraksiyonunu arttırabilir. Eğer hastanın geliş Glasgow koma skalası (GKS) <8 veya hemodinamisi anstabil ise, entübasyon ve ventilasyonun sağlanması gereklidir.
Aort diseksiyonu şüphesinde başlangıç tedavisi:
Oksijen (gerekli görülürse resüsitasyonun ABC’si)
Ayrıntılı anamnez ve fizik muayene
Kalp tepe atımı, kan basıncı, SpO2 monitorizasyonu
Damar yolu açılması, kan tahlilleri (cross match, CK, Troponin, FBC, U & Es, Myoglobin, D-dimer, LDH)
12 kanal EKG (iskeminin belgelenmesi)
Analjezi (morfin sülfat)
Dikkatli İV sıvı infüzyonu
Sistolik kan basıncının 110-120 mmHg arasında tutulması (öncelikle esmolol, metoprolol veya labetalol)
Kan basıncı için daha iyi kontrol gerekiyorsa sodyum nitroprussid (beta blokerler kontrendike ise kalsiyum kanal blokerleri)
İlk fırsatta görüntülemenin sağlanması
Uygun bir kardiyotorasik cerrahi ünitesi veya yoğun bakım ünitesine transfer
Cerrahi Tedavi
Akut tip A aort disseksiyonu olan hastalar, rüptür riskinden dolayı gecikmeden opere edilmelidirler. Bu hastalarda parapleji ve düzeltilemeyecek komorbiditelerin varlığı cerrahinin kontrendike olduğu durumlardır. Ayrıca nörolojik defisit, metabolik asidoz ve renal fonksiyon bozukluğunun eşlik etmesi kötü prognozu göstermektedir.
Aort disseksiyonunda çeşitli yaklaşımlar tanımlanmıştır. Cerrahi tedavide amaç ekspansiyonu önlemek, intimal yırtığı eksize etmek ve rüptüre olabilecek aort segmentini sentetik bir greft ile değiştirmektir (fil hortumu tekniği). Aortik kapak kurtarılamayacak durumda ise valv replasmanı yapılır ve koronerler grefte anastomoze edilir.
Tip B disseksiyonlarda ise genellikle medikal tedavi ilk tercihtir ve cerrahinin üstün olduğuna dair kanıt yoktur; fakat eğer persistan ağrı, anevrizmada genişleme, periferik iskemik komplikasyonlar ve rüptür gelişmişse cerrahi tedavi endikedir.
Komplike bir yaklaşım gerektiren aort disseksiyonunda anestezistin rolü ve anestezi uygulamasına gelecek yazıda değinilecektir.
Miray Kılıç