Bu serinin ikinci derlemesi 2007 CEACCP kaynaklı. Yağ embolisi çok sık karşılaşmasak da sonuçları çok dramatik olan bir komplikasyon.
Yağ embolisi uzun kemik kırığı veya bir başka büyük travma sonrası, genellikle asemptomatik olarak akciğer parankimi ve dolaşımda yağ globüllerinin bulunması olarak tanımlanmakta. Yağ embolizmi sendromu ise yağ embolisi sonucu ortaya çıkan klinik belirti ve bulguları tanımlayan bir kavramdır. En sık uzun kemik ve pelvisin kapalı kırıklarında görülür. Tek uzun kemik fraktüründe %1-3 yağ embolisi sendromu görülürken, bilateral femur kırıklarında %33 oranında ortaya çıkmaktadır. Yumuşak doku travması, liposuction, kemik iliği toplanması gibi vakalarda da görülebileceği unutulmamalıdır. Genel olarak mortalite %5-15 dolayındadır.
Klinik Tablo:
Yağ embolisi sendromu tipik olarak travmadan 24-72 saat sonra görülmektedir. Ama 12 saat sonra, hatta 2 hafta sonra görülen vakalar da bildirilmiştir.
Klinik triadı
– Solunum değişikliği
– Nörolojik bozukluklar
– Peteşiyal döküntüdür.
Genellikle ilk klinik belirti dispne, taşipne ve hipoksemi şeklinde ortaya çıkan solunum değişiklikleridir. Bazı hastalarda olay solunum yetersizliğine ve ARDS’den ayrılması zor bir tabloya dönüşebilir. Uzun kemik kırığına bağlı yağ embolisi sendromu gelişen hastaların yarısında ağır hipoksiye bağlı mekanik ventilasyon gereksinimi doğmaktadır.
Hafif konfüzyon ve uyku eğiliminden ciddi konvülsiyonlara dek değişebilen nörolojik değişiklikler serebral embolizasyona bağlıdır. Genellikle respiratuar distresten sonra ortaya çıkar ve vakaların %86’sında görülür. En sık akut konfüzyona rastlanmakla beraber fokal nörolojik bulgular (hemipleji, afazi, apraksi, görme alanında daralma, anizokori) ortaya çıkabilir. Hemen hemen tüm nörolojik defisitler geçici ve reversibl karakterdedir.
Karakteristik peteşiyal döküntüler trombosit fonksiyonlarından bağımsız olarak, cilt kapillerlerinin embolizasyonu ve eritrositlerin damar dışına çıkması nedeniyle ortaya çıkar. %60 vakada görülmektedir. Peteşilerin yerleşimi konjunktivada, oral mukozada, vücudun üst tarafında, özellikle boyun ve aksilladır. İlk 36 saat içinde ortaya çıkar ve 7 günde tümüyle yok olurlar.
Yağ embolisi sendromunda ateş, taşikardi, miyokardiyal depresyon, sağ kalp yüklenme bulgularına ait EKG değişiklikleri, maküler ödem skotomları ile birlikte retinal eksüdalar (Purtscher’s retinopathy), DIC’e benzer koagülasyon bozuklukları, renal değişiklikler (oligüri, lipidüri, proteinüri veya hematüri) gibi bulgular da görülebilir. Bunların nedeni ya başlangıçtaki travmaya veya disfonksiyonel lipid metabolizmasına bağlı toksik mediyatörlerin salınımına bağlanmaktadır. Bu ek tablolar tanı koymada yardımcıdır.
Yağ embolisi nedenleri:
Travmaya bağlı
– Uzun kemik kırıkları
– Pelvis kırıkları
– Diğer ilik içeren kemiklerin kırıkları
– Ortopedik operasyonlar
– Yumuşak doku travmaları (kot kırığı olan veya olamayan toraks travması)
– Yanıklar
– Liposuction
– Kemik iliği toplanması ve transplantasyonu
Travma dışı
– Pankreatit
– Diabetes mellitus
– Osteomiyelit ve pannikülit
– Kemik tümörü lizisi
– Steroid tedavisi
– Orak hücre hemoglobinopatileri
– Alkolik (yağlı) karaciğer hastalığı
– Lipit füzyonu
– Siklosporin A çözücüsü
Patogenez:
Mekanizma tam bilinmemekle birlikte mekanik ve biyokimyasal nedenler sorumlu tutulmaktadır. Yağ embolisi ya bütünlüğü bozulan yağlı dokudan veya kemik iliğinden çıkan yağ globüllerinin travmatize bölgedeki kan dolaşımına geçmesi ile (mekanik) ya da plazmaya karışan toksik yağ ara ürünleri ile (biyokimyasal) ortaya çıkar. Olaydan her iki mekanizmanın birlikte (travmatize bölgeden açığa çıkan yağın biyokimyasal degradasyonu) sorumlu olduğunu düşünmek mantıklı olacaktır.
Mekanik yağ embolisi (mekanik teori):
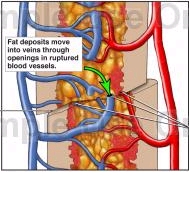
Soldaki resimde şematik olarak tibia fraktüründe açılan damarlardan yağlı kemik iliğinin dolaşıma girişi görülmektedir. Bu sendromun en fazla ilik içeren uzun kemiklerin kırıklarında görülmesi buradan venöz dolaşıma geçen yağ miktarının fazla olmasına bağlanmaktadır. Ortopedik cerrahide sağ kalbe ulaşan ekojenik materyalin saptanması mekanik teoriyi desteklemektedir. Emboli pulmoner arter ve sağ kalp basınçlarındaki artışa ve yağlı materyalin patent foramen ovale (PFO) yolu ile sistemik dolaşıma geçip paradoks emboliye neden olması ile sonuçlanacaktır. Bazı çalışmalarda PFO olmaksızın sistemik dolaşımda embolik materyal gösterilmiştir. Yüksek sağ ventrikül basıncının embolize yağ zerreciklerini pulmoner kapillerlerden iterek sistemik dolaşıma sürüklemesi buna neden olabilmektedir. Ancak bu teori sendromun travmadan 24-72 saat sonra görülmesini açıklamaya yetmemektedir.
Toksik ara ürünlerin üretimi (biyokimyasal teori):
Bir çok mekanizma düşünülmekle birlikte en fazla kabul göreni embolize yağın plazmada serbest yağ asitlerine (SYA) degradasyonudur. Kemik iliğindeki doğal yağ akut akciğer hasarı yapmamakla beraber, hidroliz ürünü SYA’nin hayvanlarda ARDS oluşturduğu gösterilmiştir. SYA kardiyak kontraktilite bozukluğu ile de ilişkilidir. Bazı hastalarda plazma lipaz konsantrasyonu yükselmektedir.
Akut hastaların serumlarının şilomikronları, düşük-dansiteli lipoproteinleri ve nütrisyonel yağ emulsiyonlarının liposomlarını agglutine etme kapasitesine sahip olduğu gösterilmiştir. Gene bu hastalarda yüksek olan C-reaktif protein lipit agglutinasyonundan sorumludur ve non-travmatik yağ embolisi sendromlarında rol alıyor olabilir. Sendromun başlamasındaki gecikme bu toksik metabolitlerin oluşması için gerekli süre ile açıklanabilir.
Tanı:
Tanı genellikle klinik bulgulara dayansa da biyokimyasal değişiklikler yararlı olabilir. En sık kullanılan Gurd’un majör ve minör tanı kriterleridir:
Majör
– Aksiler veya subkonjunktival peteşiler
– FiO2=0.4 ile hipoksemi (PaO2 60 mmHg’nin altında)
– Hipoksemi ile uyumsuz SSS depresyonu
– Pulmoner ödem
Minör
– 110 atım/dak’dan az taşikardi
– 38.5 °C’dan az ateş
– Fundoskopide retinada emboli varlığı
– İdrarda yağ bulunması
– Açıklanamayan ani Hct veya trombosit düşüşü
– Artmış sedimentasyon
– Balgamda yağ globülleri
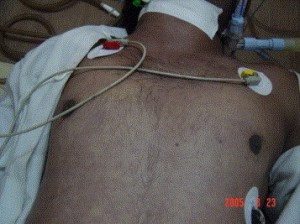 Padhi ve ark.’nın bildirdiği bir vakadan alınmış soldaki resimde göğüs duvarındaki peteşiyal döküntü izlenmektedir.
Padhi ve ark.’nın bildirdiği bir vakadan alınmış soldaki resimde göğüs duvarındaki peteşiyal döküntü izlenmektedir.
Majör kriterler klasik triada dayanmakta ve klinik tanı solunum yetersizliği, nörolojik bozukluk ve peteşilerin varlığında konulmaktadır. Peteşial döküntü patognomonik olmakla beraber %20-50 vakada bulunmaktadır. Tanı için en az 1 majör ve 4 minör kriter bulunmalıdır.
Kriterlerin güvenirliği tartışmalı olduğundan tanıda yalnız solunum yetersizliğine dayanan Lindeque kriterleri‘nin kullanılması öne sürülmüştür:
– 8 kPa altında devam eden PaO2
– 7.3 kPa’in üzerinde kalan PCO2 veya 7.3’ün altında pH
– Sedasyona rağmen 35 soluk/dak üzerinde seyreden solunum sayısı
– Artmış solunum işi: dispne, yardımcı solunum kaslarının kullanımı, taşikardi ve anksiyete
Yakın tarihte tanı için Schonfield kriterleri olarak adlandırılan semi-kuantitatif yağ embolisi indeksi ortaya konmuştur. Pozitif tanı için skorun 5’in üzerinde olması gereklidir:
– Peteşi 5
– Akciğer grafisi değişiklikleri (yaygın alveoler infiltratlar) 4
– Hipoksemi (PaO2’nin 9.3 kPa’in altında olması) 3
– Ateş (38.5 °C’nin üzerinde) 1
– Taşikardi (120 atım/dak üzerinde) 1
– Taşipne (30 soluk/dak’nın üzerinde) 1
Açıklanamayan anemi %70 hastada, trombositopeni %50 hastada saptanmaktadır. Kemik kırıklarından sonra artan serum lipaz düzeyi genellikle yanıltıcıdır. İdrar, kan ve balgamın Sudan veya yağ kırmızısı ile sitolojik incelemesinde makrofajlar içinde veya serbest yağ globülleri görülebilir. Kan lipit düzeyi sendromun şiddeti ile bağıntılı olmadığından bilgi vermez. SYA’nin kalsiyumu bağlaması nedeniyle hipokalsemi ve yüksek serum lipaz düzeyleri de bildirilmiştir.
Radyolojik bulgular tanımlanmış olsa da hiç biri tanı koydurucu değildir. Akciğer grafisi başlangıçta normal iken solunum yetersizliği ile beraber bazı hastalarda infiltrasyonlar, perifer ve tabanlarda belirgin olan konsolidasyonlar olabilir. Ventilasyon/perfüzyon sintigrafisinde subsegmental perfüzyon bozukluğu ve normal ventilasyon izlenir.
BT’de septal kalınlaşmalı opasiteler, hastalığa özel sentrinodal ve subplevral nodüller (alveoler ödem, mikrohemoraji ve iskemi/sitotoksisiteye sekonder inflamatuar cevap göstergesi) görülebilir. MR’da yüksek dansiteli T2 sinyalleri olması nörolojik bozuklukla koreledir.
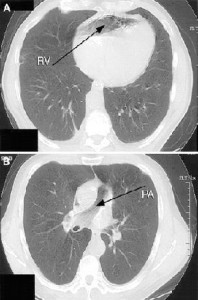
Hussain ve ark.’nın bildirdiği fatal seyirli bir yağ embolisi vakasına ait filmlere bakmanızı öneririm.
Tedavi ve Korunma:
Spesifik bir tedavisi olmayan bu sendromda korunma, erken tanı ve yeterli semptomatik tedavi çok önemlidir. Destek tedavinin kapsamında oksijenasyon, ventilasyon, stabil hemodinaminin sağlanması, gerekirse kan ürünlerinin kullanımı, hidrasyon, derin ven trombozu ve strese bağlı gastrointestinal kanama profilaksisi yer alır.
Kırıkların erken immobilizasyonu ve operasyonu emboli insidansını azaltır. Ortopedik operasyonlarda kemik içi basınç artışının sınırlanması yağın damar içine girişini azaltacaktır. Kemik medullasına delik açılıp basıncın azaltılmasının majör embolik olayları çok azalttığı gösterilmiştir. Sementsiz fiksasyon ve benzeri metodik önlemlerin de emboli riskini azalttığı bilinmektedir.
Bazı çalışmalarda insidensi ve sendromun şiddetini azalttığı gösterilmiş olmakla beraber kortikosteroid profilaksisi tartışmalıdır. Yüksek emboli riski olan hastalarda steroid profilaksisi anlamlı olabilir (metilprednizolon 1.5 mg/kg iv, 8 saat arayla, toplam 6 doz).
Bazı çalışmacılar tedavide de steroidleri önermektedir. Muhtemelen etki mekanizması anti-inflamatuar etkiye bağlı perivasküler hemoraji ve ödemin azalmasıdır. Ancak bu konuda yeterli çalışma yoktur. Aspirinin kan gazlarını düzelttiği, koagülasyon ve trombosit sayısı üzerine olumlu etki ettiği bildirilmiştir. Heparin lipaz aktivitesini arttırarak lipemik serumu temizlemektedir; bu etkisi nedeniyle tedavi için önerilmektedir. Ancak lipaz aktivasyonu SYA artışı ve bunların patogenezdeki rolü açısından potansiyel tehlike yaratabilir. Ayrıca travmada kanama riskini de beraberinde getirdiği dikkate alınmalıdır.