Anestezİstanbul-Şubat ayı toplantısı:
Kritik Hastada Organ Korunması: Tanı ve Takipte “marker”lar, önlemler
Anestezİstanbul-Şubat ayı toplantısı:
Kritik Hastada Organ Korunması: Tanı ve Takipte “marker”lar, önlemler
Sistemik hastalığı olanlarda anestezi yaklaşımı özellikler gösterir. Sistemik lupus eritematozus (SLE) multisistemik bir hastalık olması açısından pek çok patolojiyi beraberinde getirir ve anestezist açısından önem taşır. Hastalığı farklı yönleri ile ele alan bir makaleye değineceğiz:
SLE farklı klinik görünümleri olan kronik otoimmün bir konnektif doku hastalığıdır. Perioperatif anestezi yönetiminde SLE hastalığı gibi kompleks multisistemik tutulumu olan hastaları değerlendirirken akut alevlenme dönemleri, kompleks tedavi rejimleri, koagülasyon bozuklukları ve hastalığın sonucu gelişen organ hasarları konusunda ayrıntılı inceleme yapılmalıdır.
SLE hastalığının sıklığı 7,4-159.4/100000 olarak bildirilmektedir. Kadınlarda erkeklere oranla 9 kat fazla görülmektedir. En sık 15-40 yaşları arasında ortaya çıkmaktadır.
Patogenez:
SLE patogenezinde vücut hücrelerine karşı otoimmün bir cevap ve genetik faktörlerin rol aldığı düşünülmektedir.
Bazı ilaçlara maruz kalma lupus benzeri hastalıklara yol açabilir veya SLE’yi şiddetlendirebilir. İlaçların indüklediği lupus eritematozus (LE) için standardize edilmiş diagnostik kriter olmamasına rağmen, bazı vakalarda farmakolojik ajana en az bir ay süreyle maruz kalma ve ilacı kestikten sonra hastalığın gerilediği görülmüştür. İlaçların indüklediği LE’da çoğunlukla artralji ve serozit gibi daha hafif semptomlar mevcuttur ve genellikle major organ tutulumu yoktur.
Tanı:
“American College of Rheumatology” tarafından SLE tanısı için ilk olarak 1982’de yayınlanan kılavuz, 1997 yılında yenilenmiştir. SLE için 11 tanı kategorisi belirlenmiştir. Bunlardan herhangi dördünün saptanması SLE tanısına götürmektedir.
SLE Tanı Kriterleri:
Yeni kılavuzda serolojik testlerin değerlendirmesi önem kazanmıştır. Serolojik biomarker olarak tanımlanan “anti-double -stranded DNA” (anti-dsDNA) SLE hastalarında %70 oranında pozitif bulunmaktadır. Normal popülasyonda veya diğer otoimmün hastalıklarda ise bu oran %0.5’dir. Antinükleer antikor (antinuclear antibody) pozitifliği SLE’de %99 iken normal popülasyonda da 1/40 sulandırmada %32 oranında saptanmaktadır. 1/160 sulandırmada ise bu oran %5’e düşmektedir.
Tanı için belirlenen 11 kriter ise şöyle sıralanmaktadır:
Yüzde döküntü
Diskoid döküntüler
Fotosensitivite
Oral ülserler
Artrit: İki veya daha fazla eklemde nonerozif artrit
Serozit: Plörit veya perikardit
Böbrek hastalığı: Günde 0.5 gramdan daha fazla olabilen persistan proteinüri, eritrosit, hemoglobin, granüler, tübüler veya karışık tipte hücre silendirleri
Nörolojik tutulum: Konvülzyonlar veya psikoz
Hematolojik bozukluklar: Hemolitik anemi veya lökopeni (<4.000) veya lenfopeni (<1.500) veya trombositopeni (<100.000) )
İmmunolojik bozukluklar: anti-ds DNA antikoru veya anti-Sm antikoru veya antifosfolipit antikoru (beraberinde şunlardan birisi bulunur: anormal serum IgG ya da IgM anti-kardiyolipin antikor seviyeleri veya lupus antikoagülan pozitifliği veya
yalancı pozitif sifiliz testleri [VDRL pozitif, TPHA negatif])
Antinükleer antikor (ANA) pozitifliği: ANA pozitifliği yapacak bir ilaç olmaksızın 1/80 ve üzerindeki titreler
Klinik Görünüm:
SLE’nin çok farklı klinik görünümlere neden olması tanı koymada gecikmelere yol açabilmektedir. En sık belirtiler raş, fotosensitivite, artrit, plevrit, perikardit, nefrit, nöropsikiyatrik ve hematoloji bozukluklardır. Ayrıca daha az sıklıkla görülen fakat potansiyel tehlikeli komplikasyonlar da mevcuttur.
SLE’nin majör manifestasyonları şunlardır:
Dermatolojik: Yüzde raş (%50), kronik diskoid lezyonlar (%25)
Nörolojik: Konvülsiyonlar (%7-20)
Kardiyovasküler: Asemptomatik perikardit (>%50), semptomatik perikardit (%25), perikard tamponadı, miyokardit (%5-10), Libman- Sacks endokarditi (%10), valvüler disfonksiyon, Raynaud fenomeni (%30-40)
Pulmoner: Plörit (%35), pnömonit, diffüz alveoler hemoraji, pulmoner hipertansiyon (%0.5-14)
Renal: Lupus nefriti (%60), son dönem böbrek hastalığı
Hematolojik: Kronik hastalık anemisi (%40), otoimmün hemolitik anemi (%5-10), otoimmün trombositopeni (%10)
Gastrointestinal: Ağız ülserleri (%7-52), Sjorgen sendromu, disfaji, akut abdominal ağrı (%40), karaciğer fonksiyon testlerinde anormallik (%60’a varan oranda), otoimmün hepatit
İskelet-kas sistemi: Artrit (%15-50), osteoporoz (%23), kırıklar (%12.5), asemptomatik atlantoaksiyal sublüksasyon (%8.5)
Laringeal Tutulum:
Laringeal komplikasyonlar uzun süredir bilinmekte ve sıklıkları %0.3-30 olarak bildirilmektedir. SLE hastalarının laringeal tutlumlarına bağlı olarak hafif inflamasyon, vokal kord kord paralizisi, subglottik stenoz, laringeal ödem, epiglotit, romatoid nodüller, enflamatuar kitleler, krikoaritenoidit görülebilir. Hastaların çoğunluğu immünsüpresif tedaviye cevap verdiği için laringeal tutluma bağlı oluşabilecek patolojiler nadiren acil endotrakeal entübasyon ya da cerrahi trakeostomi gerektirir. Aktif SLE olan hastalarda kısa süreli bile olsa yapılan trakeal entübasyonlardan sonra subglottik stenoz olabileceği belirtilmiştir.
Enfeksiyonlar:
SLE hastalarında gerek intrinsik eğilim gerekse immünsüpresif tedaviyle ilişkili olarak enfeksiyon oranı fazladır. Enfeksiyonların çoğunluğu bakteriyeldir; deri, solunum ve üriner sistemi etkiler. Enfeksiyon oluşumunda rol oynayan faktörler SLE aktivasyonu, hastalığın süresi, sitopeni, kompleman düzeyinde düşüklük, böbrek tutulumu, merkezi sinir sisitremi tutulumu ve immünsupresif tedavidir.
Viral enfeksiyonlar lupus alevlenmesini taklit ederler; genellikle SLE tedavisine yanıt alınmayınca tanı konur. Tipik viral belirtiler olan artralji, raş, ateş, halsizlik, lenfadenopati ve sitopeni lupus alevlenmesi ile karıştırılır. Sitomegalovirus ve parvovirüs B19 en sık görülen viral ajanlardır.
Kanser:
SLE hastalarda çeşitli kanser tiplerinin görülme sıklığı artmıştır. Çalışmalar SLE ve kanser riski ilişkisini ortaya koymuştur. Non-Hodgkin lenfoma en sık birliktelik (%3.6) gösterirken daha az sıklıkla meme, akciğer ve servikal kanserlerlede ilişkisi saptanmıştır.
Antifosfolipid Antikorları ve Antifosfolipid Sendromu (APS):
APS tek başına veya otoimmün hastalıklara sekonder ortaya çıkabilen bir hastalıktır. Arter ve venöz trombozlarla seyreder. Hastalığın tanısında kullanılan lupus antikoagülanı (LAC) veya antikardiyolipid antikorlar (aCL) SLE hastalarında da bulunmaktadır. LAC bulunan SLE hastalarının %53’ünde tromboembolik komplikasyonlar görülmektedir. Primer APS’ye göre aPL antikoru saptanan SLE hastalarında tromboz riski daha yüksek olmaktadır. Gene SLE’de ortaya çıkan APS’da mortalite primer AOS’a oranla daha fazladır.
Tedavi:
SLE tedavisinde kullanılan başlıca ilaçlar NSAİD’ler, antimalaryaller, aspirin ve immünsüpresiflerdir. Kullanılan immünsüpresifler organ tutulumlarına bağlı olarak kortikosteroidler, siklofosfamid, azatioprin, metotreksat ve mikofenolat mofetildir; tek başına veya kombine tedavi olarak uygulanırlar.
Perioperatif yönetim açısından kullanılan bu ilaçların toksik profillerinin bilinmesi önemlidir. Siklofosfamid kullanımına bağlı olarak gelişen kardiyotoksisitede akut dekompanzasyon ve sistolik fonksiyon azalması bildirilmiştir. Hidroksiklorokin kullanımına bağlı nörotoksisite, kardiyotoksisite, retinotoksisite gösterilmiştir. Azatiopirin ve metotreksat kullanımına bağlı hepatotoksisite, ayrıca metotreksat kullanımına bağlı pulmoner fibrozis olabileceği belirtilmiştir. Mikofenolat mofetil ciddi derecede miyelosupresyon yapabilir. Glukokortikoid kullanımına bağlı hiperglisemi, hipertansiyon, osteoporoz, hiperkolesterolemi oluşabilir. Glukortikoidlerin ani kesilmesi sonucunda veya cerrahi strese bağlı Addison krizi tetiklenebilir.
Farmakoterapiye bağlı gelişen komplikasyon ve yan etkiler şunlardır:
Anti-malaryaller (hidroksiklorokin): Retinotoksisite, nöromiyotoksisite, kardiyotoksisite
Kortikosteroidler (prednizon, metilprednizon, topikal preparatlar): Hiperglisemi, hiperkolesterolemi, hipertansiyon, osteoporoz
Aspirin, NSAİ ilaçlar: Peptik ülserasyon, trombosit inhibisyonu, böbrek yetersizliği, sıvı retansiyonu/ elektrolit bozuklukları, hepatik disfonksiyon, bronkospazm
Siklofosfamid: Miyelosupresyon, psödokolinesteraz inhibisyonu, kardiyotoksisite, lökopeni, hemorajik sistit
Azatioprin: Miyelosupresyon, hepatotoksisite
Metotreksat: Miyelosupresyon, hepatik fibroz/siroz, pulmoner infiltratlar/fibroz
Mikofenolat mofetil: Gastrointerstinal problemler, pansitopeni
SLE’da İzlem:
İzlem klinik pratikte aktivasyonu organ hasarındaki artıştan ayırmaya dayanır. Bu amaçla çeşitli hastalık aktivite indeksleri ortaya konmuştur (Systemic Lupus Erythematosus Disease Activity Index, Systemic Lupus Activity Measure vb).
ANESTEZİ:
SLE’nin anestezi üzerine etkisi şimdiye kadar yeterince incelenmemiştir. Anestezistler SLE hastalığın birçok belirtisi olduğu bilmeli ve hastalığın akut alevlenmeleri ve organ hasarları iyi değerlendirilmelidir. Obstetrik ve kardiyak anestezide, özellikle antifosfolipid antikor ya da APS varlığında hastaların özelleşmiş merkezlerde multidispliner yaklaşımla değerlendirilmeleri gereklidir. Preoperatif değerlendirmede, perioperatif immünsüpresiflerin devamı ve steroid replasmanı dikkate alınmalıdır.
Vegara Fernandez yaptığı çalışmada hastalığı aktivasyonu ve mortalite arasında ilişki saptanmamasına rağmen acil olmayan cerrahi operasyonların hastalığın alevlenme dönemlerinde ertelenmesi önerilir.
Anestezik ilaçlarla immünsüpresifler arasındaki ilaç etkileşimlerine dikkat edilmelidir. Azatioprin kas gevşeticileriyle etkileşerek atraküryum dozunu %37, veküronyum dozunu %20,panküronyum dozunu %45 arttırdığı yapılan bir çalışmada gösterilmiştir. Siklofosfamid psödokolinesteraz inhibitörü gibi davranarak suksinilkolin kullanımından sonra uzamış apne periodlarından sorumludur. NSAİD’lerle metotrekasatların birlikte kullanılması sonucunda akut renal yetmezlik ve pansitopeni oluşan vakalar bildirilmiştir. Nitrik oksit kullanımı da kemik iliği depresyonunu tetikleyebilir.
Anestezi alacak SLE hastalarının preoperatif değerlendirme, intraoperatif ve postoperatif yönetimi için öneriler preoperatif, intraoperatif ve postoperatif dönem açısından ayrılarak dikkate alınmalıdır.
Preoperatif Değerlendirme:
Hikaye: Hastalık aktivite indeksi, organ hasarı ve ilaç kullanımı değerlendirilmelidir.
Muayene: Kardiyovasküler, respiratuar, nörolojik sistem muayene edilmeli, atlantoaksiyal sublüksasyon belirti ve bulguları aranmalıdır.
Tam kan sayımı: Anemi, trombositopeni, lökopeni aranmalı, anemi varsa hemoliz için ek testlere başvurulmalıdır.
Serum elektrolitleri, kreatinin, üre: Herhangibir olumsuz sonuç varsa lupus nefriti için ek değerlendirmeye gidilmelidir.
Karaciğer fonksiyon testleri: Normal dışı sonuçlarda otoimmün veya ilaç hepatotoksisitesi açısından araştırmaya geçilmelidir.
Koagülasyon testleri: Yüksek aPTT lupus antikoagülanının araştırılmasını gerektirir.
Anti-dsDNA, kompleman düzeyleri: Önceki değerlerle karşılaştırılarak değerlendirme yapılmalıdır; lupus aktivasyonunu yansıtabilir.
İdrar analizi: Proteinüri, eritrosit, lökosit, hücresel silendirler klinik olarak sessiz hastalığa işaret edebilir; ileri tetkik yapılmalıdır.
EKG: Sessiz iskemi, miyokardit, perikardit, ileti bozuklukları görülebilir.
Toraks filmi: Plevral efüzyon, interstisyel pnömonit, perikardiyal efüzyon, subglottik stenoz görülebilir.
İntraoperatif Dönemde Dikkat Edilecek Noktalar:
5 derivasyon EKG: Beklenmeyen koroner iskemi ve ileti bozukluklarının erken fark edilmesini sağlar.
İnvazif kan basıncı monitorizasyonu: Vakaya göre karar verilmelidir; miyokardit, ileti bozukluğu, kapak disfonksiyonu, otonom disfonksiyon olan hastalarda uygulanmalıdır. Raynaud fenomeni varsa dikkatli olunmalıdır.
Uygun ise laringeal maske kullanımı: İnflamasyon ve postekstübasyon havayolu ödemi olasığı nedeniyle havayolu manipülasyonunu azaltmak açısından uygun seçenek sağlar.
Zor havayolu için önlem alınması, gerektiğinde kullanılmak için daha ince endotrakeal tüplerin hazırlanması: Vokal kord paralizisi, subglottik stenoz, laringeal ödem entübasyonu güçleştirebileceğinden hazırlıklı olunmalıdır.
Standart antibiyotik profilaksisi: Enfeksiyonlara duyarlılık ve immunosupresif tedavi nedeniyle enfeksiyon riskinin artmış olduğu dikkate alınmalıdır.
Kas gevşeticilere dikkat: Azatioprin ve siklofosfamit kas gevşeticilerle etkileşebilir.
Böbrek koruyucu stratejiler: İdrar çıkışı korunmalı, hipoperfüzyon ve hipotansiyondan kaçınılmalı, nefrotoksik ilaçlar kullanılmamalıdır. Subklinik lupus nefriti olasılığı unutulmamalıdır.
Hasta pozisyonuna dikkat edilmelidir: Periferik nöropati ve osteoporoza yatkınlık olduğu unutulmamalıdır.
Antitrombotik profilaksi: Özellikle antifosfolipid antikorları da varsa, mekanik ve farmakolojik önlemler erken alınmalıdır. Lupus antikoagülanı olanlar ve geçirilmiş tromboembolik olayı bulunan hastalarda hematolog ile konsülte edilerek terapötik antikoagülasyon uygulanmalıdır.
Gözlerin korunması ve suni göz yaşı/lubrikasyon kullanımı: Sjorgen sendromu uygun şekilde gözler kapatılsa bile kornea hasarına yatkınlık yaratabilir.
Vücut sıcaklığının izlenmesi: Hipotermi Raynaud fenomeni olan hastalarda vazospazmı indükleyebilir.
Analjezi: Sistemik analjeziklerin yan etkileri dikkate alınmalıdır. Nöropati, miyelit ve koagülopatiler ekarte edilebiliyorsa rejyonal teknikler yararlı olabilir.
Kortikosteroid şemsiyesi: Uzun süreli kortikosteroid kullananlarda adrenal supresyon gelişebilir; preoperatif “stres doz” uygulanması gerekir.
Postoperatif Dönem:
Analjezi: Hasta düzenli izlenmeli ve özelleşmiş ağrı servisi tarafından analjezi sağlanmalıdır; sistemik yan etkilerin en azda tutulmasına özen gösterilmelidir.
Antitrombotik profilaksi: Cerrahi faktörler dikkate alınarak mekanik ve farmakolojik profilaksi erken dönemde başlanmalıdır.
Özetleyecek olursak SLE multisistemik otoimmün bir hastalıktır. Aktivasyonu değişik klinik bulgularla ortaya çıkabilir, farklı organ tutulumlarına neden olabilir. Prognozdaki iyileşmelerle sürvi uzadığından giderek daha fazla SLE hastası çeşitli nedenlerle operasyona gereksinim duymakta ve anestezistin karşısına çıkmaktadır. Özellik arzeden bu hastalar hasta bazında değerlendirilmeli, preoperatif değerlendirme sonuçlarına göre uygun peroperatif yönetim ve postoperatif bakım sağlanmalıdır.
Ayhan Kaydu
Modern tıptaki gelişmelerle hem toplumda, hem de ameliyathanede karşılaştığımız yaşlı nüfus (ki epidemiyologlar tarafından yaşlı genelde 65 yaşın üzerinde tanımlanmaktadır) artmaktadır. Yandaş hastalıkların yokluğunda dahi bu hastalar genç nüfusa kıyasla perioperatif fizyolojik değişikliklere ve farmakolojik girişimlere farklı yanıtlar vermektedir. Bu ayki Anesthesiology derlemesinde daha çok yaşlılardaki değişmiş farmakolojik cevaplar üzerinde durulmuş, biz de konuyu 2 yazı ile sizlere özetleyelim istedik…. Pek çok örnekte yaşlı hastalar ilaçlara daha duyarlıdır; bu derlemede geçen “duyarlı” sözcüğü de farmakokinetik veya farmakodinamik nedenle belirli bir ilaç dozuna karşı gelişen abartılı cevap anlamında kullanılmaktadır.
Yaşlanma Sırasında Normal Fizyolojik Fonksiyon:
İnsanlar yaşlandıkça genel olarak organ fonksiyonunda bir azalma meydana gelir, ancak bu azalmalar hem organ sistemleri arasında hem de kişiden kişiye büyük farklılıklar gösterir. Dahası, bu hastaların kardiyovasküler ve pulmoner sistemleri fonksiyon kaybettiği için anestezi ve cerrahi esnasındaki fizyolojik cevapları etkilenebilir. Nispeten sağlıklı yaşlı hastalar bu azalmış fonksiyonları strese girmedikçe göstermeyebilirler. Yani, normal aktivitelerde yeterli fonksiyon gösterseler de major cerrahi ve anestezi gibi orta-ağır stres halinde bu durumu tolere edemeyebilirler. Kronik hastalık veya kronik hastalığın akut alevlenmesi hastanın perioperatif strese verdiği cevabı daha da engelleyebilir.
Yaşlanmaya ve yaşla beraber gelişen hücresel hasara ilişkin pek çok teori (örneğin hücrelerin DNA replikasyonu yapamaması ve normal bölünememesi, serbest radikaller gibi reaktif metabolitlerden kendilerini koruyamamaları gibi) bulunmaktadır. Dahası, insanlar yaşlandıkça protein yapıları değişir ve bu da yaşla beraber gelişen fizyolojik değişiklerin pek çoğundan sorumludur. Örneğin, kan damarı genişleyebilirliği yaşlı hastalarda belirgin şekilde azalır ve bu endotelyal disfonksiyon ve artmış intimal kalınlıkla birleşince hem sistolik kan basıncının artmasına hem de sol ventrikül iş yükünün artmasına neden olacaktır. Miyokardiyal hipertrofi, artmış kollajen birikimi ile beraber bir sol ventrikül yaratır ki bu da kalp debisinin korunması için yeterli preload (önyüke) ihtiyaç duyulması anlamına gelir. Bu yaşlı hastaları sıvı yüklenmesine daha açık hale getirir. Dahası, körleşmiş barorefleksler geriatrik hastaların hipovolemiye karşı normal cevabı daha zor vermelerine ve ilaç tedavisi ile ortostatik hipotansiyona daha açık hale gelmelerine neden olur. Tüm bu değişimler beraber ele alındıklarında, yaşlı hastaları sıvı hareketleri ve kan kaybına daha duyarlı hale getirir.
Yaşlanmayla beraber solunum sistemi de belirgin değişiklikler gösterir: Zorlu ekspiryum hacmi azalır, fizyolojik şant ve kapanma hacmi artar. Bu solunum değişikleri perioperatif dönemde yaşlı hastaları atelektazi, pnömoni ve hipoksiye eğilimli kılar.
Yaşlı hastalar, genç olanlarla kıyaslandığında daha fazla yağ dokusu daha az kas dokusu ve azalmış oplam vücut sıvısına sahiptir. Renal fonksiyon zaman içinde azalır ve bu azalmış glomerüler filtrasyon hızı (GFR) ve bozulmuş sekresyon olarak kendini gösterir. Glomerüler filtrasyon hızına dayanan kreatinin klirensi Cockroft–Gault formülüne göre hesaplanabilir.
GFR üzerindeki değişiklikler bireyden bireye geniş farklılıklar gösterir. Azalmış kas kitlesi nedeniyle, serum kreatinin seviyesi düşmüş GFR’ye rağmen normal sınırlarda kalabilir. Tüm bu faktörler ilaçların farmakokinetiğini etkiler. Buna ilave olarak, protein bağlanmasındaki değişiklikler serbest ilaç miktarını değiştirirler. Bu özellikle yüksek oranda proteine bağlanan ilaçlar için önemlidir.
Yaşlı hastalar postoperatif dönemde özellikle deliryum ve kognitif fonksiyonlarda azalmaya eğilimlidirler ve bu komplikasyonlar artmış mortalite ile ilişkilidir. Örneğin yaşlı hastalarda postoperatif kognitif disfonksiyon insidansı hastaneden çıkışta %41, çıkıştan 3 ay sonra %13 olarak bildirilmektedir. Preoperatif hafıza ile ilişkili şikayetler erken demansın bulguları olabilir ve buna uygun olarak değerlendirilmelidir. Her ne kadar bu ciddi komplikasyonların etiyolojisi bilinmese de, ilerleyen yaş, düşük sosyoekonomik seviye ve serebral inme hikayesinin olması gibi bir takım risk faktörleri bulunmaktadır. Bu risk faktörlerinin varlığı anestezisti aşırı ilaç maruziyeti ile istenmeyen sonuçlarla karşılaşma konusunda dikkatli olmaya itmektedir.
Farmakokinetik:
Yaşlanma işlemi perioperatif dönemde kullanılan pek çok ilacın hem farmakokinetiğini (“vücudun ilaca ne yaptığını” yani ilacın kan ve değişik dokulara dağılımı ve metabolizması) hem de farmakodinamiğini (ilacın vücuda ne yaptığını yani ilaç tarafından gerçekleştirilen farmakolojik istenen ve istenmeyen etkileri) değiştirir.
Genel bir kural olarak yaşlı hastalar ilaçlara daha hassastır çünkü hem verilen herhangi bir doz için farmakokinetik değişikliklere bağlı olarak ilaç plazma konsantrasyonu daha yüksektir, hem de verilen ilaca karşı hassasiyet artmıştır. Herhangi bir ilaç dozu için, plazma konsantrasyonu ve dağılım hacmi birbirleriyle ters orantılıdır. Yaşlandıkça toplam vücut suyu azalır ve yine yaşla birlikte diüretik kullanımı artar. Bu nedenle daha küçük dağılım hacmine sahip hidrofilik ilaçlarda herhangi verilen bir doz için daha yüksek plazma konsantrasyonları gözlenir. Bu sonuçta daha fazla farmakolojik etki oluşmasına neden olur. Örneğin morfinin yaşlılardaki dağılım hacmi gençlerin neredeyse yarısı kadardır. Ancak yine de ilaç etkisi önemli ölçüde etki yerindeki dağılım hacmine bağlıdır.
Diğer yandan vücut yağ oranının artışıyla yağda çözünen ilaçların dağılım hacmi artar. Bu durumda yağda çözünen ilaçların eliminasyonu gecikir. Buna en iyi örneklerden biri diazepamdır; diazepamın eliminasyon yarı ömrü yaşlılarda birkaç kat artar. Bu uzamış yarı ömür tek doz diazepam için sorun yaratmasa da, tekrarlayan dozlarda daha ciddi sorun yaratır.
Pek çok anestetik ilaç bir dereceye kadar proteine bağlanan ilaçlardır. Albümin yaşlılarda %20 kadar azalır, bu oran kötü beslenme ile daha da fazlalaşabilir. Propofol özellikle proteine bağlı bir ilaç olduğundan, orta derecede azalmış albümin düzeyleri bile propofol serbest ilaç miktarını önemli şekilde etkiler.
Hepatik Metabolizma:
Yaşlanma ile karaciğerin hem büyüklüğü, hem de kan akımı azalır. Karaciğer ağırlığı tüm erişkin yaşamı boyunca neredeyse sabit kalırken (yaklaşık tüm vücut ağırlığının %2.5’i), 50 yaşın üzerinde karaciğer ağırlığı giderek azalır ve 90 yaşında vücut ağırlığının %1.6’sını karşılar hale gelir. Benzer şekilde hepatik kan akımı giderek azalır (yılda %0.3-1.5 oranında) ve 25 ile 65 yaş arasında hepatik kan akımında yaklaşık %40 azalma meydana gelir.
Karaciğer ilaçları faz I ve II metabolizma yoluyla elimine eder. Faz I öncelikli olarak sitokrom P450 sistemi ile katalizlenir ve ilaç oksidasyonu, redüksiyonu ve hidrolizini içerir. Faz I aktivitesinin yaşla azalıp azalmadığı bilinmemektedir. Diğer faktörler (örneğin sigara içimi, sedanter yaşam, diyet) yaştan daha büyük bir etkiye sahiptirler. Yine de anestezistler yaşlı hastalarda faz I metabolizmasının azalma olasılığını göz önüne almalıdırlar. Faz II metabolizması asetilasyon ve konjugasyonu içermektedir. Pek çok çalışma bu fazın yaşlanmadan etkilenmediğini göstermektedir. Yüksek ekstraksiyon oranına sahip ilaçlar, karaciğerden geçerken bir anlamda “temizlenirken”, düşük ekstraksiyon oranına sahip ilaçlarda karaciğer geçişi sonrası konsantrasyonda azalma meydana gelmez. Yüksek ekstraksiyonlu ilaçlar kan akımına bağlıdır ve bu nedenle klirenslerinde “akım sınırlı” olmalarından bahsedilir. Düşük ekstraksiyon oranına sahip ilaçlarsa karaciğer büyüklüğü, total enzim kapasitesi gibi intrensek klirense bağlıdır ve bu nedenle “kapasite sınırlı” olarak adlandırılırlar. Her ne kadar konjugasyonlu ajanların intrensek klirensi yaştan etkilenmese de , yüksek ekstraksiyon oranına sahip ilaçların (örneğin ketamin, flumazenil, morfin, fentanil, sufentanil ve lidokain) eliminasyonu doğrudan karaciğer kan akımına bağlıdır. Yaşlı hastalarda bu ilaçların klirensi , karaciğer kan akımındaki azalmaya paralel şekilde %30-40 kadar azalır. Yaşlılarda total karaciğer büyüklüğündeki azalmaya bağlı olarak düşük ekstraksiyon oranı gösteren ilaçların intrensek klirensi azalır diye düşünülebilir; ancak bu ikisi arasında ilişki gösterilememiştir. Yine de azalmış albümin seviyeleri nedeniyle ilacın serbest kısmı artar ve bu da azalmış hepatik metabolizmanın etkilerini karşılar.
Böbreklerden Eliminasyon:
Yaşlandıkça, kısmen ilerleyen glomeruloskleroza bağlı olarak, böbrek fonksiyonları azalır. Glomerüller sayıca azaldıkça ve daha az fonksiyonel hale geldikçe, glomerüler filtrasyon hızı azalır. Bunun dışında yaşla beraber renal kan akımı azalır. Tüm bu sıralananlar 20 ila 90 yaşı arasında GFR’de %25-50 azalmaya neden olurlar. Bu nedenle yaşlılarda primer olarak böbrek yoluyla elenen ilaçların klirensinde azalma beklenir. Anestetik ilaçlarda dahil olmak üzere tüm ilaçlar bir miktar glomerüler filtrasyona uğrar. Yağda çözünen ilaçlar ( ki bunlar arasında pek çok anestetik ilaç ve adjuvan ilaçlar da bulunur) tubullerde tekrar geri emilirken, suda çözünen metabolitler salgılanır. Aktif metabolitler (örneğin morfin-6- glukoronit) ve bazı suda çözünen metabolitler (örneğin bazı kas gevşeticiler) eliminasyon için böbreğe bağımlıdır. Bu nedenle azalmış renal fonksiyon bu ilaçların atılımını etkileyebilir.
Farmakodinamik:
Bir ilacın etki büyüklüğü, etki bölgesindeki konsantrasyonu dışında hedef bölgedeki reseptör sayısına, sinyal transdüksiyonuna (reseptör stimülasyonuna cevap verme yeteneğine) ve normal fonksiyonların korunmasına yönelik homeostatik işlemlere dayanır. Farmakodinamik geriatrik nüfusta farmakokinetik kadar fazla çalışılmamıştır. İlaçlara hassasiyet yaşla artabilir veya azalabilir. Örneğin yaşlı hastalar farmakokinetik değişiklikler göz ardı edildiğinde bile, bezodiazepinlere daha fazla hassasiyet göstermektedirler. Bu hassasiyetin nedeni olarak GABA tip A reseptörlerinde yaşla meydana gelen değişiklikler suçlanmaktadır. Yine de yaşlı hastalar perioperatif dönemde kullanılan bazı ilaçlara daha fazla direnç gösterebilirler. Örneğin geriatrik nüfus adrenerjik agonist ve antagonistlere (örneğin isoproterenol veya propranolol) daha az hassastır. Yaşlılarda azalmış reseptör sayısı ve/veya affinitesi ile beraber hücresel cevapta değişikliklere sık rastlanır. Gecikmiş homeostatik işlemlerde anestetik ilaçlara karşı gelişen kardiyovasküler hassasiyetti açıklayabilir. Yani, anestetik ilaçlar (örneğin propofol) hipotansiyona neden olabilir ve gençlerde buna karşı gelişen artmış kalp hızı ve kontraktilite cevabı yaşlılarda gecikebilir.
Güncel Anestezinin son iki bölümü pediatrik hastalarda peroperatif sıvı idamesi ve replasmanı üzerineydi. Kafalar berraklaşacağına daha çok karıştı sanırım. Konu henüz netlik kazanmış değil. Laktat metabolizması ve karaciğer fonksiyonları dikkate alındığında pediatrik grupta ringer laktat problem yaratabilir mi diye bir sürü literatür karıştırdım. Çocukta sıvı resüsitasyonunda kristalloid seçilecekse salin ve ringer laktat öneriliyor (British Journal of Anaesthesia, CEPD Reviews, Volume 3 Number 1, 2003).
Erişkinde ringer laktatın içeriğinin fizyolojik elektrolit düzeylerine daha yakın olduğu ve büyük miktarlarda sıvı resüsitasyonunda hiperkloremik asidoza yol açan saline oranla üstünlüğü ve ilk seçenek olması gerektiği bildirilmiş (Continuing Education in Anaesthesia, Critical Care & Pain, Volume 4, Number 4, 2004). Öte yandan hemorajik şokta çok miktarda eksojen laktat (ringer laktat solüsyonu) kullanılarak resüsite edilen erişkinlerde kan laktat düzeyinin şoka bağlı laktat artışından daha fazla olduğu da bildirilmiş (Anasthesiol Intensivmed Notfallmed Schmerzther 2002, 37:356). Gelecekte laktatsız solüsyonların daha yaygın kullanılacağı düşünülüyor.
Travma hastalarında hastaneye girişte bakılan laktatın sürvi için prognostik olduğu çok sayıda çalışma ile belirlenmiş. Sıvı resüsitasyonu için kullanılan ringer laktat bu değeri etkileyip yanıltıcı olabilir mi deniyor (Critical Care 2005, 9:441-453).
Günlük laktat döngüsü 1300 mmol/24 saat olabiliyor. Laktat karaciğerde glukoneogeneze girip metabolize ediliyor, hidrojen iyonları kullanılıyor, bikarbonat ise asidozu düzeltmede işe yarayabiliyor. Kritik hastada bu metabolik yol bozulursa veya artan bikarbonatın renal atılımı etkilenirse (kritik hastaların bir kısmı zorunlu asidik idrar üretiyor) alkaloz ve hipokalemi gelişebiliyor. Diabetes mellitusta ise şeker kontrolü kötü vakalarda laktatın glukoza dönüşümü ile glukoz düzeyi artacağından ringer laktattan kaçınılması gerekiyor (Continuing Education in Anaesthesia, Critical Care & Pain, Volume 5, Number 5, 2005).
Laktatın hepatik metabolizması 100 mmol /saat; akut renal yetersizlikte ise bu 0.6 mmol/kg/saat’e düşebiliyor (Intensive Care Med 1999; 25: 1209). Ringer laktatta 29 mmol/L olduğu düşünülürse hemodinamisi iyi normal hastada peroperatif replasmanda kullanımı sorun yaratmayacaktır. Ciddi karaciğer hastalığında metabolik hızı düşeceğinden ringer laktat seçilecek sıvı olmamalı. Öte yandan karaciğer transplantasyonunda özellikle anhepatik fazda laktatın böbrek fonksiyonları iyi hastada beklendiği oranda artmadığı biliniyor ve bu da renal laktat metabolizmasına bağlanıyor.
Bu uzun girişten sonra gelelim yeni konumuza:
Plazma laktat konsantrasyonunun normal değeri 0.3-1.3 mmol/L ve laktat üretimi ile laktat metabolizması arasındaki dengeyi ifade ediyor. İnsanda laktat L-isomeri halinde bulunuyor.
Normal Laktat Üretimi
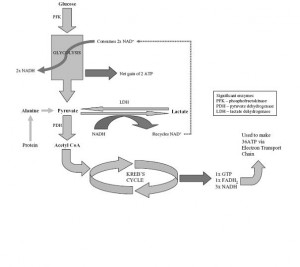 Figür 1‘de (solda) glikoliz ve laktat üretimi görülmekte.
Figür 1‘de (solda) glikoliz ve laktat üretimi görülmekte.
Laktat ve Laktik Asidoz
Laktik asitten dissosiye olan H+ iyonları oksidatif fosforilasyon ile ATP üretiminde kullanılabilmekte. Laktat üretimi devam ederken oksidatif yolda bozukluk olursa H+ iyonları artıp asidoza yol açıyor. Ağır egzersiz sırasında oksidatif fosforilasyonun devam etmesi ciddi boyuttaki laktat üretimine rağmen asidoz gelişmesini engelliyor.
NADH ve NAD+
Glikoliz NAD+ (nikotinamid adenin dinukleotid) üretimini gerektirir. NADH sunumu piruvatın laktata dönüşüm hızını denetler. Kalp gibi çok miktarda ATP gerektiren dokuların piruvatın asetil CoA’ya dönüşümüne gereksinimi vardır. NADH düzeyini düşük tutmak için mitokondrial membranda elektronların taşınmasına yardım edecek ve NADH’yı NAD+ haline okside edecek taşıyıcılar kullanılır. Malat-aspartat yolu temel taşıyıcı mekanizmadır. Gliserol-fosfat taşıyıcı yolu ise sekonder role sahiptir. Bu ikisi oks-fos taşıyıcı olarak bilinir.
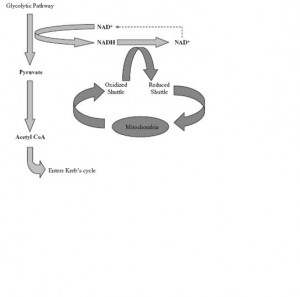 Figür 2‘de (solda) oks-fos taşıyıcı sistemi görülmekte.
Figür 2‘de (solda) oks-fos taşıyıcı sistemi görülmekte.
Glikoliz hızı oks-fos taşıyıcı sisteminin kapasitesini aşacak ölçüde artarsa NADH konsantrasyonu artar ve laktat üretimi ile NAD+’yı rejenere eder; sonuçta laktat konsantrasyonu yükselir.
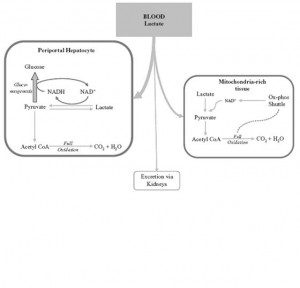 Figür 3‘de (solda) laktatın plazmadan uzaklaştırılması şematik olarak izlenmekte.
Figür 3‘de (solda) laktatın plazmadan uzaklaştırılması şematik olarak izlenmekte.Laktat ve Kritik Hastalık
Ciddi asidoz (pH<7.35)> 5 mmol/L olduğunda mortalite %80’dir.
1. Kardiyak Arrest ve Resüsitasyon
Kardiyak arreste veya ağır hipovolemiye bağlı hipoksi anaerobik metabolizmayı tetikler. Laktat düzeyi direkt olarak hücre hipoksisini yansıtır. Hastane içi kardiyak arrest sırasında ve spontan dolaşımın başlamasından 1 saat sonra bakılan laktat düzeyi sürvi için prediktiftir.
2. Sepsis
Sistemik inflamatuar cevap sendromunda (SIRS) veya erken sepsiste hiperlaktatemi doku hipoksisini yansıtabilir. Oksijen sunumunun erken dönemde arttırılabilmesi sonucu iyileştirebilir. Sepsis tablosu oturduktan sonra bakılan laktat düzeylerinin yorumlanması zordur. Stabil septik hastaların oksijen sunumu artmıştır; doku oksijen düzeyleri genellikle anaerobik metabolizmayı tetikleyen düzeyin üzerindedir. Bozulmuş laktat klerensi genellikle artmış üretimden daha önemlidir. Bu hastalarda aerobik laktat üretimi stres altında karbonhidrat metabolizmasının değişimine bağlı olabilir. Dikloroasetat piruvat dehidrogenaz aktivitesini arttırarak ve septik hastada kan laktat düzeyini düşürmektedir, ancak hemodinami veya sürvi üzerine etkisi yoktur.
3. İntestinal İnfarkt
Barsak hipoksisi anaerobik metabolizmaya yol açar. Karaciğere portal ven üzerinden daha fazla laktat ulaşır. Başlangıçta peripotal hepatositler laktatı okside eder veya glukoza çevirir. Bakteriyel translokasyon ve ciddi sıvı kaçağı dolaşım kollapsına katkıda bulunur. Global olarak oksijen sunumu azalır. Endojen katekolamin salgılanması dolaşımı ayakta tutmaya çalışır, ama aynı zamanda glikoliz ve laktat oluşumunu da arttırır. Şok geliştiğinde hepatik kan akımı azalır intrasellüler asidoz laktattan glukoneogenez oluşumunu inhibe eder. Karaciğerde laktat klerensi yerine üretimi baskın hale gelir. İntestinal bakteriler glukozu ve karbonhidratı D-laktat’a metabolize eder. Bu ise insan LDH’ı tarafından yavaş olarak metabolize edilebildiğinden ve laktik asidoz oluşumuna katkıda bulunur.
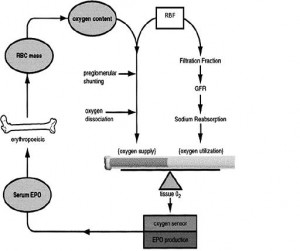 Böbrek, plazma volümü ve eritrosit kütlesini kontrol ederek ve bu iki komponente dayanarak hematokriti (Hct) belirlemekte. Böbrek içi doku oksijen sinyaline göre böbrek indirekt olarak kan volumunu algılıyor ve eritropoietin (EP) üretiyor. EP üretimi anjiotensinII (anjII) tarafından module ediliyor, dolayısı ile renin-anjiotensin sistemi EP üretimine kan volüm regülasyonu feedback’inin efektor sinyali olarak katılmış oluyor. Yani böbrek yalnızca EP üreticisi değil aynı zamanda Hct belirleyicisi oluyor ki bu da bizim kan volümü regülasyonu hakkındaki bilgilerimize yeni bir boyut eklemekte.
Böbrek, plazma volümü ve eritrosit kütlesini kontrol ederek ve bu iki komponente dayanarak hematokriti (Hct) belirlemekte. Böbrek içi doku oksijen sinyaline göre böbrek indirekt olarak kan volumunu algılıyor ve eritropoietin (EP) üretiyor. EP üretimi anjiotensinII (anjII) tarafından module ediliyor, dolayısı ile renin-anjiotensin sistemi EP üretimine kan volüm regülasyonu feedback’inin efektor sinyali olarak katılmış oluyor. Yani böbrek yalnızca EP üreticisi değil aynı zamanda Hct belirleyicisi oluyor ki bu da bizim kan volümü regülasyonu hakkındaki bilgilerimize yeni bir boyut eklemekte.Dolasimdaki kan miktari, kardiyovaskuler sistemin etkinligini maksimumda tutacak sekilde ayarlanir. Hct ise, oksijen sunumunu kardiyovaskuler is veya kan akimi ile maksimumda tutacak sekilde ayarlanır. Bu iki parametre birbiri ile bagintili olsa da regulasyonlari farkli mekanizmalar ile olur.
Kan volumu ve Hct regulasyonunda 4 anahtar nokta rol oynar:
Kan volumunun plasma komponenti bir feedback sistemi ile ayarlanir: Vasküler dolgunluk ve kan basincini algilayan aferent sinyaller merkezi sinir sisteminde (MSS) islenir; olusan efferent sinyaller renal Na ve su atilimini duzenler.
Yeterli doku oksijenasyonunu garantileyen eritrosit kutlesinin regulasyonu gene bir feedback sistemi ile saglanir. Burada bobregin rolu EP uretimidir.
Bobregin ‘critmeter’ fonksiyonu plazma volumu ve eritrosit kutlesinin, Hct regulasyonu surecindeki koordinasyonunu ayrintilandirmaktadir.
AnjII’nin EP uretimine etkisi, kan volumu ve Hct regulasyonu eslesmesi ile tanimlanmistir.
I. Plasma Volumu Regulasyonu
Ekstraselluler sivi (ESS) volumu, afferent sensorler (volum ve basinc) ve efferent efektor mekanizmalardan olusan bir feedback halkasi sayesinde dar sinirlar icinde idame ettirilir. Sinyaller MSS’de islenerek efektor organlara Na ve su atilimi yoluyla vaskuler kapasitansin dengesini saglayacak optimal kan volumunu duzenleyecek efferent sinyaller gonderilir. Bu modelde kanin yalnizca plazma komponenti ile ilgili duzenleme soz konusudur.
Afferent yolda lokal, bolgeye ozel dusuk basinc (volum degisikligini algilar) ve yuksek basinc sensorleri vardir. Dusuk basinc sensorleri kardiyopulmoner (atriyal, ventrikuler ve pulmoner), renal ve hepatik reseptorleri icerir. Atriyal gerilim reseptorleri plasma volum artisina bagli atriyal duvar gerilimini algilar ve vagal afferent sinyalleri uyarir. Boylece ADH sekresyonu azalir, su emilimi azalarak su diurezi olusur. Atriyal gerilim reseptorleri ayrica kardiyomiyositik atriyal natriuretik peptit (ANP) sekresyonunu stimule eder; buna bagli renal Na atilimi artar, renin uretimi ve aldosteron sekresyonu azalip distal Na emilimi duser. Bu multipl effektor mekanizmalar ile plazma volum dengesi duzeltilir. Ventrikuler basinc reseptorleri ventrikuler basinc dususunu algilar ve vagal afferentleri stimule ederek renin sekresyonunun sempatik stimulasyonunu inhibe eder. Kucuk hava yollarinin bronsial venulleri (pulmoner sensorler) sol atriyal basinctaki hafif artisa ve pulmoner lenfatik obstruksiyona cok hassastir. Stimule olduklarinda refleks su diurezi ortaya cikar.
Bobrek afferent arteriollerindeki basinc reseptorleri basinc degisikliklerine hassastir. Miyojenik refleksin parcasi olarak afferent arterioldeki basinc artisi burada refleks vazokonstriksiyona, tam tersi ise vazodilatasyona yol acar. Jukstaglomeruler kompleks distal Na gecisine hassastir. Na miktari azalinca renin, anjII, aldosteron sekresyonu artar ve olusan efferent vazokonstriksiyon ile GFR ve distal Na reabsorbsiyonu artar (tubuloglomeruler feedback). Miyojenik refleks ve tubuloglomeruler feedback renal kan akiminin otoregulasyonunu saglar.
Hepatik dusuk basinc baroreseptorleri hepatik venoz sistemdeki basinc degisikliklerini algilar. Hepatik venoz konjesyon vb. nedenlerle basinc artarsa MSS’e sempatik afferent sinyaller gonderilir ve renal+kardiyopulmoner efferent aktivite artar. Sonucta renin-anjiotensin-aldosteron yukselir, tubuler Na ve su reabsorbsiyonu artisi ve kardiyak debide artis saglanir.
Arkus aorta ve sinus karotikustaki arteryel baroreseptorler de afferent sensorlerdir. Ortalama arter basinci (MAP) ve nabiz basinci degisikliklerini algilarlar. Ani MAP dususu normalde olan afferent vagal ve glossofaringeal afferent tetiklemeyi azaltir; medullaya giden inhibitor sinyaller azalinca, kalp ve bobrege giden efferent sempatik sinyallerin inhibisyonu ortadan kalkar. Sonucta perfuzyon basinci artar ve sivi dengesi duzeltilir.
II. Eritrosit kutlesinin regulasyonu
Dokuya oksijen sunumunu belirleyenler kan oksijen icerigi (oksijen saturasyonu ve Hb konsantrasyonu), kan akimi (kardiyak debi lokal vaskuler kan akimi) ve oksijenin Hb’den dissosiasyonudur (doku duzeyinde Hb’in O2’e afinitesi). Yeterli sunum, kan akimi veya oksijen icerigindeki (content) degisikliklerle saglanir. Akim degisikligi ise tum dokularda kardiyak debi veya rejyonel kan dagilimi ile ayarlanabilir. Eritrosit kutlesi renal EP uretimine baglidir. Doku hipoksisine cevap olarak korteksteki peritubuler fibroblastlar EP uretir; EP ile kemik iliginde eritrosit uretimi stimule olur. EP uretimi, oksijen sunumu ve renal dokunun oksijen gereksinimi tarafindan yonetilen bir feedback halkasi ile calisir. Hct dusunce plasma EP duzeyi ters logaritmik olarak artar.
Dokunun metabolik gereksinimi, dokuya gelen kan akiminin belirleyicisidir. Ama renal dokuda bu kuralin aksine kan akimi, GFR ve renal Na reabsorbsiyonuna olan etkileri nedeniyle indirekt olarak renal metabolik gereksinimi belirler. Ayrica renal kan akiminin otoregulasyonu nedeniyle, dıger dokulardan farkli olarak oksijen sunumunu duzenlemek icin olusacak kan akimi degisiklikleri de bobrekte kisitlidir. Bu nedenle bobrege oksijen sunumunda anahtar rolu ustlenen oksijen icerigidir. EP uretimi bobregin dusuk oksijen tansiyonuna (oksijen sunumu ile tuketimi arasindaki net fark) karsi effektor cevabidir; boylece eritrosit kutlesinin belirleyici olarak bobrek anahtar rol ustlenmektedir.