HIV Maruziyeti Sonrası Profilaksi
Maruziyet sonrası profilaksi uygulama kararı şu faktörlere dayanmaktadır:
- HIV enfeksiyonunun patogenezi
- Antiretroviral ilaçların bulaşmayı engelleyebilme olasılığı
- Temas eden kişide profilaksinin kar zarar ilişkisi.
Primer HIV enfeksiyonları ile ilgili bilgi, hemen sistemik enfeksiyonun ortaya çıkmayacağı ve bir “fırsat penceresi” bırakacağı, dolayısı ile temas sonrası antiretroviral girişimlerin hücre içine virus girişini ve replikasyonunu değiştirebileceği yönündedir. Hayvan çalışmaları iğne batması gibi inoküle olan virüs miktarının az olduğu durumlarda erken profiloksiye başlamanın yararlı olduğunu göstermiştir.
İnsanlarda ise profilaksinin etkinliğini değerlendiren randomize klinik çalışma yoktur. Sağlık çalışanlarında yapılmış bir retrospektif vaka kontrol çalışmasında temas sonrası profilaksi için Zidovudine kullanımının riski %81 azalttığı gösterilmiştir. Antiretroviral tedavinin anneden infanta viral geçişi azalttığı da gösterilmiştir. Ayrıca, birkaç vakada Zidovudine’nin başarısız olduğu da bildirilmiştir.
Profilaksi Rejimi Seçimi
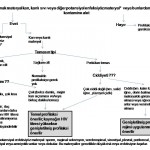
Rejim seçimi, kaynak hastanın antiretroviral tedavisi, o andaki klinik durumu ile ilgili bilgileri (CD4 miktarı, viral yükü, hastalığın evresi) ve maruziyetin derecesine göre yapılır (bkz. alttaki resim).
Antiretroviral ilaçlar 3 sınıf olarak sıralanırlar:
1- Nukleozid analoğu reverse transkriptaz inhibitörleri (nucleoside analogue reverse transcriptase inhibitors, NRTI)
2- Non-nukleozid analoğu reverse transkriptaz inhibitörleri (non-nucleoside reverse transcriptase inhibitors, NNRTI)
3- Proteaz inhibitörleri.
Bu 3 grupta birçok antiretroviral ilaç olmasına rağmen Zidovudine’nin insanlarda HIV geçişini engellediği ispatlanmıştır. Bu yüzden tüm rejimlerde Zidovudine ilk ilaç olarak seçilir. Buna eklenen diğer ilaçların temas sonrası profilaksinin etkinliğini arttırdığına dair kanıt yoktur. Ama HIV enfeksiyonu olan hastalardada kombine tedavi kullanımının monoterapiden daha yaralı olduğu, viral yükü azalttığı gösterilmiştir. Bu yüzden mesleki maruziyet durumunda, teorik olarak viral replikasyonun farklı evrelerini etkileyecek ilaçların kombine verilmesi önerilmektedir (örn. NRTI + protease inhibitörü). Ancak ilaç seçimi ve kombinasyonlar ampirik yapılmaktadır.
Lamivudine 2. ilaç olarak önerilmektedir. Nedeni Zidovudine+Lamivudine kombinasyonunun yüksek antiretroviral aktiviteye sahip olması ve Zidovudine’e dirençli vakada ek toksisiteye neden olmadan Lamivudine’in etkinliğinin gösterilmiş olmasıdır.
Çoğu HIV maruziyetine genellikle 2 NRTI (Zidovudine+Lamivudine) ile başlanır. Diğer iki NRTI ise Lamivudine+Stavudine kombinasyonudur.
Eğer diğer ilaçlara direnç varsa ve bulaşma yüksek riskli ise, eklenecek 3. ilaç olarak genelde bir proteaz inhibitörü (indinavir/nelfinavir) veya bir NNRTI olan efavirenz düşünülmelidir. Indinavir’in 3. ilaç olarak tercih edilme nedeni biyoyararlanımının yüksek olması ve kısa dönem kullanımda toksisitesinin az olmasıdır. NNRTI’lerin yan etkisi sık görülmekle beraber uzun süreli temas sonrası profilaksilerde masrafını düşürdüğü için Efavirenz seçilmelidir. Nevirapire ve Delavirdine yüksek hepatotoksisite riskleri nedeniyle rutin kullanımda önerilmemektedir.
Günümüzde temas sonrası profilaksi için 2 rejim önerilmektedir: 2 ilaçlı “temel” rejim ve bulaşma riskinin yüksek olduğu durumlar için 3 ilaçlı “genişletilmiş” rejim.
HIV maruziyeti sonrası uygulanan temel ve genişletilmiş profilaksi rejimleri için örnekler:
Temel 2-ilaç rejimi
Zidovudine 600 mg/gün 2 veya 3 bölünmüş dozda + Lamivudine 150 mg günde iki kez
Lamivudine 150 mg günde iki kez + Stavudine 40 mg günde iki kez (<60 kg ise 30 mg günde iki kez)
Didanosine 400 mg/gün (<60 kg ise 125 mg günde iki kez) + Stavudine 40 mg günde iki kez (<60 kg ise 30 mg günde iki kez)
Genişletilmiş (3-ilaç) rejimi
Yukarıdaki temel 2-ilaç rejiminden biri + aşağıdakilerden birisi:
Indanavir aç karnına 8 saat arayla 800 mg
Nelfinavir yemek veya atıştırmalık ile beraber günde üç kez 750 mg veya günde iki kez 1250 mg
Efavirenz yatarken 600 mg/gün
Abacavir günde iki kez 300 mg
Profilokside Zamanlama ve Toksisite Monitorizasyonu
Profilaksi mümkün olan en kısa zamanda (teması izleyen ilk birkaç saat içinde) başlamalıdır. Hayvan çalışmalarına 24-36 saatten sonra başlanıldığından profiloksinin daha az etkin olduğun gösterilmiş olmakla beraber ama insanlar için böyle bir süre belirlenmemiştir. Bu yüzden maruziyetten sonra 36 saat geçse de profiloksiye başlanmalıdır. Süre uzarsa, örneğin 1 haftayı geçerse bulaş riskinin arttığı hesaba katılmalıdır.
Temas eden kişi 72 saat sonra tekrar değerlendirilmelidir: Temas anında kaynağın HIV ile enfekte olup olmadığı bilinmeden profilaksiye başlanmış ve 72 saat sonra testlerde HIV negatif sonucu alınmışsa, temas edene uygulanan profilaksi kesilmelidir.
Profilaksinin optimal süresi bilinmemekle beraber, genelde 4 hafta uygulanması kabul edilmektedir.
İlaç toksisitesi için başlangıçta ve terapiye başladıktan 2 hafta sonra test yapılmalıdır. Testler total ve diferensiyal kan sayımını, renal fonksiyon testlerini (indinavir kullanan hastalarda) ve karaciğer fonksiyon testlerini kapsamalıdır. Eğer protease inhibitörü kullanılıyorsa kan şekeri bakılmalıdır. İndinavir kullanılıyorsa kristalüri, hematüri, hepatit ve hemolitik anemi açısından takip yapılmalıdır. Ayrıca profilaksi uygulanan sağlık çalışanının medikal hikayesine göre gerekirse başka testler de uygulanmalıdır. Eğer toksisite saptanırsa, rejim değiştirilmelidir.
Kayıtlara göre HIV maruziyeti olan ve profilaksi başlanan sağlık çalışanlarının yarısında yan etkiler görülmekte, 1/3 kadarı bu nedenle tedaviyi kesmek zorunda kalmaktadır. Profilaktik tedaviyi kesenlerin büyük bölümü 3 ilaçlı rejimin uygulandığı kişilerdir. Bu nedenle klinisyenlerin tedavi süresini tamamlama açısından risk-yararlanım dengesini iyi değerlendirmeleri önem kazanmaktadır.
Toksisitenin Değerlendirilmesi ve Tedavinin Kesilmesi
Toksisite saptandığında, değerlendirme için başka testlerin gerekliliği ve tedavi rejiminin değiştirilmesi uzman konsültasyonu istenerek değerlendirilmelidir. Profilaksi alan sağlık çalışanına uygulanan ilaçların en sık rastlanan yan etkileri (kızarıklık, ateş, sırt ağrısı, karın ağrısı, dizüri, hematüri veya hiperglisemi semptomları) ve bunlar görüldüğünde tıbbi değerlendirme yapılmasının önemi hakkında bilgi verilmelidir. Ayrıca olası ilaç etkileşimleri ve profilaksi sırasında kaçınılması gereken ilaçlar konusunda da gerekli bilgiler anlatılmalıdır.
Antiretroviral İlaçların Yan Etkileri
Nükleosid revers transkriptaz inhibitörleri (zidovudine, lamivudine, stavudine, didanosine gibi) bulantı ve diyareye neden olurlar. Bu etkiler genellikle motilite azaltıcı ilaçlar veya antiemetikler ile ya da doz aralığının değiştirilmesi ile giderilebilirler. Ancak doz aralıkları değiştirilmeden ilaç üreticisinin önerileri mutlaka dikkate alınmalıdır. Abacavir aşırı duyarlılık reaksiyonlarına neden olabilir; geç toksisite (onkojenik veya teratojenik) potansiyali de bilinmemektedir.
Proteaz inhibitörleri (indinavir, nelfinavir gibi) hiperglisemi, diabetes mellitus gelişimi ve dislipidemiye neden olurlar. Dolayısı ile kan şekeri kontrolü yapılmalıdır. Indinavir nefrolitiyazise neden olabilmekle beraber, günde 1.5L sıvı içilmesi ile bu yan etki kısıtlanabilir.
Non-nukleozide analoğu reverse transkriptaz inhibitörleri (örn. efavirenz) ağır cilt reaksiyonlarına (Stevens-Johnson sendromu da dahil olmak üzere) neden olabilir. Efavirenz sesemlik, uyku bozukluğu ve rüya görme gibi santral sinir sistemi yan etkilerine sahiptir.
Bu grubun diğer bir ilacı olan Nevirapine, ciddi yan etkileri nedeniyle (fulminan hepatit gibi) mesleki maruziyet sonrası profilaksi için önerilmemektedir.
HIV Antikor Testi
Profilaksi alsın almasın, mesleki maruziyet sonrası sağlık çalışanına mutlaka emzim immunassay ile HIV antikoru bakılmalıdır. Maruziyetten sonra da en az 6 ay süresince test tekrarlanmalıdır (örn. 6 hafta, 12 hafta ve 6. ay). Uzun süreli takip (örn. 12. ayda) önerilen vakalar ise aynı anda HCV ve HIV ile enfekte kaynaktan mesleki maruziyet sonrası HCV enfeksiyonu kapmış olanlar için önerilmektedir. HCV ve HIV ile enfekte vakaya temas sonrası HCV serokonversiyonu gelişmeyen sağlık çalışanlarına uzun süreli takip gerekliliği ile ilgili bilgi bulunmamaktadır.
Emosyonel Stres
HIV ile temas emosyonel stres yaratabilir. Sağlık çalışanı bir paradoks ile karşı karşıyadır: HIV geçiş olasılığı yüksek riskli temas sonrasında bile düşük olmasına rağmen 4 hafta ilaç alması, ayrıca sekonder bulaşı önlemek için bazı şeylerden uzak durması gerekmektedir (örn. cinsel ilişkiye girmemesi veya kondom kullanması, kan, plazma, sperm veya organ bağışı yapmaması, emzirmeyi kesmesi gibi). Bu nedenle mesleki HIV transmisyonunda uzman olanlarla teması sürdürmesi, gerekli her türlü bilgiyi alması gerekmektedir.
Hamillelik Sırasında İlaçların Kullanımı
Anitiretroviral ilaçların gelişen fetus ve yenidoğandaki etkisi hakkındaki bilgiler yeterli değildir. İlaçların kullanımı için annenin sağlığı ve anne-fetus açısından kar zarar durumuna göre karar verilmelidir. Efavirenz gibi primatlarda teratojenitisi gösterilmiş bazı ilaçlar kullanılmamalıdır. Stavudine ve didanosine kombinasyonu ile gebe kadında fatal laktik asidoz bildirilmiştir. YD’da hiperbilirubinemi yaptığından doğumdan hemen önce indinavir verilmemelidir.
Çalışanları Serokonversiyonlarının Değerledirilmesi ve Profilaksi Gereksinimi
Eğer kaynak HIV pozitif ise, maruz kalan çalışan HIV serokonversiyonu açısından belli aralıklarla teste tabi tutulmalıdır. İlk başta bazal olarak bakılmalı sonrasında 6. haftada, 3. ayda ve 6. ayda bakılmalıdır. Vakaların %95’inde maruziyetten 6 ay sonra serokonversiyon oluşur. Bu yüzden profiloksi gereksinimine maruziyetin ciddiyetine (örn. kan bulaşmış kalın ve lümenli iğne ile yaralanma veya kaynak hastanın arter ya da venine girmiş iğne ile derin yaralanma ciddi olarak değerlendirilirken, cilde/müköz membrana kısa süreli birkaç damla kan gelmesi hafif maruziyet olarak tanımlanır) ve HIV evresine göre karar verilmelidir.
Daha ayrıntılı bilgi Varghese ve Alvarado-Ramy’nin yazılarında bulunabilir.
En önemli noktanın primer koruma olduğu ve sağlık çalışanlarının bu amaca yönelik güvenlik tedbirlerine titizlikle uymaları gerektiği unutulmamalıdır.
Maruziyet sonrası profilaksi rejiminin belirlenmesi:
Elif Caymaz