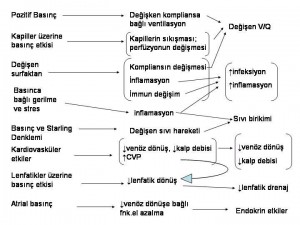
Pozitif basınçlı ventilasyonun kardiyovasküler sistem üzerindeki etkileri iyi bilinmektedir. Normal solunumda inspiryumdaki negatif basınç fazı venöz dönüşe yardımcı olur, pulmoner kapillerdeki basıncı azaltır ve akımı teşvik eder.
Pozitif basınçlı ventilasyon sırasında ise intratorasik basınçlar inspiryum sırasında artar ve böylece venöz dönüşte, sağ ventrikül debisinde ve pulmoner kan akımında bir azalma meydana gelir. Paradoksal şekilde sağ ventrikül impedansında da bir azalma vardır ancak bunun venöz dönüşteki azalmayı hafifletip hafifletmediği bilinmemektedir. Ayrıca PEEP uygulamasında PEEP artışı ile sağ ventrikül debisinin azalma eğilimine girdiği ve böylece sol ventrüle dönüşünde azaldığına dair kanıtlar vardır. Bu etki bir miktar intratorasik-ekstratorasik basınç farkının artışı ile sol ventrikül debisinin artmasıyla hafifletilir. Bu özellikle kalp yetersizliğinde yardımcı olabilir, ancak artmış intratorasik basıncın debiyi azalttığı diğer durumlarda pek işe yaramaz.
Ekspiryumda, intratorasik basınç sıfıra döner ve böylece venöz dönüş artar.
Eğer PEEP uygulanmışsa, pozitif intratorasik basınç ekspiryum sırasında venöz dönüşü engellemeye devam eder. Ventilasyon ve PEEP uygulaması ile inferior vena kavanın kollaps olabilme yeteneğindeki azalma, bariz bir venöz staz göstergesidir. Sıvı verilmesi venöz dönüşü ve kardiak debiyi iyileştirir ancak bunu artmış santral venöz basınçlar ve dolayısıyla akciğer ve diğer organlarda artmış kapiller sonu basınçlar pahasına yapar.
Pozitif basınçlı ventilasyon aynı zamanda su ve tuz tutulumu ile beraberdir. Klasik olarak bunda azalmış atrial genişlemeye bağlı anti-diüretik hormon (ADH) salgılanması suçlanmasına rağmen yakın zamanda atrial natriüretik peptid (ANP) de suçlanmaktadır. Bunun düzeltilmesi amacıyla daha fazla sıvı verilmesi dah da fazla sıvı tutulması ile sonuçlanacaktır.
Pulmoner kapiller damarlar ve kan akımı:
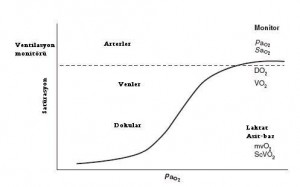
Ortalama pulmoner kapiller basınç 7-10 mmHg civarındadır ve bu pulmoner arter ile pulmoner ven arasındaki basınç farkından kaynaklanmaktadır. Kapiller damarların gidiş trasesi boyunca yer alan bir interstisyel basınç artışı olmadığı sürece, intratorasik basınç tüm kapiller üzerinde etki gösterip, gradyenti çok etkilemez. Normal solunum esnasında, interstisyumda ve alveoldeki basınçlar, kapiller perfüzyon basıncına kıyasla çok azdır. Bu düşük basınçlı sistem kompartmanlar arasında besleyici maddelerin ve sıvının geçişini hidrostatik ve onkotik kuvvetler etkisiyle kolaylaştırırken, beraberinde engellenmemiş bir akımını da sağlar. Dahası akciğerdeki basınçlar genelde tüm fazlardaki kapiller basınçlardan daha düşüktür ve kapiller kan akımını pek etkilemezler. Bu durumun 2 istisnası vardır: atriumdan daha yüksekte kaldığı için basınç gradyanının daha düşük olduğu yerler ve teorik olarak yerçekimine bağımlı alanlar- burada da akciğer dokusunun ağırlığı kapilleri kıstırabilir. Ancak tüm bu etkiler küçük ve geçicidir.
Hastalıkda ise işler değişir. Kronik obstrüktif akciğer hastalığı olanlarda hiperinflasyon (akciğerde havalanma artışı) ile beraber ekspiryum sırasında interstisyumu ve kapilleri sıkıştıran ve bu şekilde kapiller rezistansı arttırıp kanın akımını değiştiren yüksek intratorasik basınçlarla karşılaşılır. İnspiryumda ise intratorasik basınçlar azaldıkça, akım düzelir.
Kritik hastada pozitif basınçlı ventilasyon sırasında- tepe basınçları 30 mmHg ile sınırlansa bile- interstisyel basınç belirgin şekilde artar, kapiller damarları basıya uğratıp akımı yavaşlatır. Ekspiryumda, eğer 15 mmHg’lık bir PEEP uygulanmışsa bu da kapiller basıncın üstünde olduğundan, akımı sekteye uğratabilir. Kompansatuar mekanizmalarda bu durumda değişebilir. Hipoksik vazokonstriksiyon –ki prekapillerdir ve spontan solunumda, düşük basınçlarda çok etkin şekilde kanın akış yönünü değiştirebilir- dıştan gelen basıncın büyüklüğü ile etkisiz hale gelebilir.
Kapiller basıncın kendisi de, prekapiller vazokonstrüksiyon sonucu sadece minimal artış (yaklaşık 1 mmHg kadar) gösterir, bu nedenle kapilller basınç halen eksternal basınçlardan etkilenmeye devam eder.
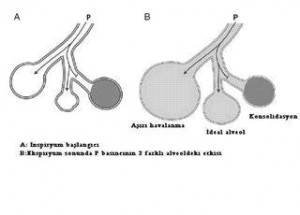
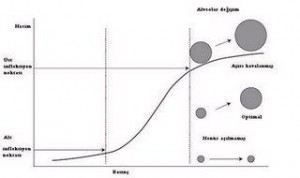
Yüksek rakımda yaşayan insanların bazılarında hipoksiye karşı, daha genel ancak her şeye rağmen yer yer heterojenlik gösteren pulmoner arter basıncı yükseklikleri gözlenir; bunun amacının akımı etkilemek ve uygun olan yerlere akımı yönlendirmek olduğu düşünülmektedir. Pozitif basınçlı ventilasyon sırasında, kompliansı iyi olan akciğer bölgeleri üzerlerine uygulanan basıncı kapillerin sıkışmasına neden olacak şekilde yansıtır; buna karşılık kompliyansı düşük olan hasarlı veya infekte akciğer bölgeleri üzerlerine uygulanan basıncın çok azını yansıtırlar ve bu nedenle daha iyi bir perfüzyonları vardır. Hipoksik vazokonstrüksiyon ne yazık ki bu büyüklükteki değişiklikleri kompanse edemez. Sonuçta ventilasyon-perfüzyon uyumsuzluğu kaçınılmaz hale gelir.
Pozitif basınçlı ventilasyona ikincil yüksek venöz basınçlar aynı zamanda Starling kuvvetlerini oluşturan basınçları da olumsuz etkileyecek ve interstisyel alanda sıvı birikimini arttıracaktır. Kritik hastada pulmoner arter basınçlarının artışı, yüksek akciğer basınçları ve sürekli yüksek venöz basınçlar olasılıkla kapiller endotelin bütünlüğünü de bozacaktır.
Sonuç olarak akciğer fonksiyonu için kapiller perfüzyon basıncı ana öneme sahiptir. Sürekli artmış intratorasik basınç beraberinde kapillerin basıya uğraması ile kapiller akımın bozulması, Starling kuvvetlerinin değişmesi ve artmış kapiller sonu basınçlar gibi sonuçları doğurur. Kompansatuar mekanizmalar çoğu zaman bu değişiklikler karşısında işe yaramaz ve tam tersi ventilasyon-perfüzyon uyumsuzluğunu arttırır.
Lenfatikler:
Lenfatikler en azından 2 fonksiyona hizmet eder, drenaj ve savunma. Akciğer sürekli kötü filtrelenmiş yüksek hacimdeki hava ile karşılaşan büyük bir yüzey alanına sahiptir. Sıvı, retiküloendotelyal sistem vasıtasıyla interstisyumdan alınır ve yabancı maddeler yine aynı sistemce dolaşıma katılmadan temizlenir. Akciğer lenfatikleri interstisyumda yer alan ve tek yönlü akımı sağlamak amacıyla valvler içeren ince, tek hücreli bir kanaldan oluşurlar.
İnspiryum esnasında, akciğerdeki negatif basınç interstisyuma ve dolayısıyla lenfatiklere yansır ve oluşan basınç gradyeni lenfatiklere sıvı girişini sağlar. Bu son derece etkin bir sistemdir ve lenf akımı gerektikçe, büyük miktarda artabilir. Lenfatikler doldukça, basınç artar ve
ventilasyon hareketi ile akım gerçekleşir. Hilusa doğru, küçük kanallar birleşir ve öncesinde büyük kanalları, sonrasında da santral venlere boşalan lenfatikleri veya torasik duktusu oluştururlar.
Periferik lenfatiklerdeki basınç maksimum 4 mmHg civarındadır, bu basınçta akım en iyi haldedir; ancak basıncın artması ile duvarlar gerilir ve kaçak gerçekleşir. Bu 4 mmHg’lık basınç aynı zamanda inspiryum sırasında iyice azalan santral venlerdeki basınçla yeterli gradyenin oluşmasını ve lenf akımının venlere doğru olmasını sağlar. Toplayıcı kanallar biraz daha detaylıdır ve düz kas içerirler. Bu lenfatiklerin bir miktar direnç artışını tolere etmesini sağlar, ancak yine de lenfatikler hem çıkış yolundaki direnç artışı, hem de lenfatik duvarlar üzerine basınç artışı ile çok kolay basıya uğrayabilirler.
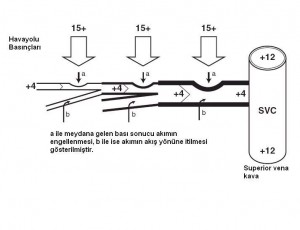
Pozitif basınçlı ventilasyon sıvıları alveolden interstisyuma, ve potansiyel olarak lenfatiklere doğru iter. İnterstisyumdaki pozitif basınç ise periferik lenfatiklerden bazılarını sıkıştırarak akıma yardımcı olabilir ancak beraberinde ince duvarlı lenfatikleri de sıkıştırdığı için akımı durdurabilir. İkinci bir etki de ventilasyonla beraber yükselen santral venöz basınçtır ve lenfatik basınç tek haneli sayılarda olduğu sürece akıma karşı ciddi bir hidrostatik bariyer oluşturacaktır; böylece lenfatik akım yine engellenecektir. Ekspiryum sırasında azalmış intratorasik basınç ve azalan santral venöz basınç akımı tekrar başlatsa da, yüksek PEEP kullanılması bunu da engeller. Tüm bu nedenlerden ötürü pozitif basınçlı ventilasyon, PEEP uygulamasında olduğu gibi akciğer sıvısını arttırır. PEEP aslında alveolden sıvı çıkışını arttırırken, torasik duktus drenajını azaltması nedeniyle interstisyumdaki sıvıyı arttırır.
Deneysel oluşturulan akciğer hasarında, PEEP lenf oluşumunu arttırır ancak drenajını zorlaştırır. Bir fistül oluşturarak torasik duktus içindeki akımın ölçülmesi halinde hem pozitif basınçlı ventilasyonun hem de PEEP’in lenf akımını arttırdığı gözlenir ancak unutmayın fistül sayesinde santral venöz basınçlar bypass edilmektedir. Anestezi altında PEEP ile solutulan hayvanlarda, yüksek atrial basınca rağmen torasik duktus drenajı sağlandığında daha az pulmoner ödem oluştuğu gözlenmiştir. Lenfatik drenajın azalması zaman içinde akciğerde, plevral boşluklarda sıvı toplanması ve akciğer infeksiyonlarına yatkınlıkla sonuçlanabilir.
Akciğerde lenfatik drenajı infeksiyonla direkt ilişkilendiren bir kanıt yoktur, ancak diğer sistemlerde, örneğin kronik lenfödemde infeksiyon riskinin arttığı bilinmektedir.
Dolaylı yoldan bazı kanıtlar mevcuttur. Örneğin başka herhangi bir problemi olmayan ancak bir nedenle ventilasyona başlanan hastalarda nozokomial pnömoni gelişim süresi lenfatik obstrüksiyonun etkilerinin görülme süresine uyar. Yine akciğer transplantasyonu sonrasında, ilk bir kaç gün infeksiyon oranı yüksek ve antikor cevabı minumumdur. Bu hastalarda lenfatik drenaj en erken 2. haftada sağlanabilmektedir. Bunun dışında CVP’nin 7 mmHg üzerinde olması akciğer transplantında mortaliteyi arttırmaktadır.
Organ sistemleri ve pozitif basınçlı ventilasyon:
Pozitif basınçlı ventilasyonun diğer organlar üzerinde en bariz etkisi kardiyak debideki azalmaya bağlıdır. Böbrekler üzerinde baskın etki glomerüler filtrasyon hızında düşme ve kardiak debideki azalmaya bağlı olarak intra-renal kan akımının yön değiştirmesidir. Bu her iki durum da sıvı verilmesi veya spontan solunumun katıldığı bir ventilasyon moduna geçilmesi ile düzelebilir.
PEEP’in hepato-splankik dolaşım üzerindeki etkilerinin bazıları sıvı verilerek düzeltilebilir ki bu da olayların kalp debisinin azalmasına bağlı olduğunu desteklemektedir. Ancak venöz konjesyon veya azalmış hepatosplanknik lenfatik drenaja bağlı azalmış portal kan akımı veya artmış hepatik kan hacmi söz konusu ise sıvı vermek işe yaramaz. Sepsisde 10 mmHg PEEP ile hepatik metabolik fonksiyon bozulurken, aynı bozulma kardiyak cerrahi sonrası bu düzeyde izlenmez.
Sonuç:
PEEP ve pozitif basınçla ventilasyon hem anestezi, hem de yoğun bakımda etkinliği kanıtlanmış bir tedavi metodudur. Ancak bu tedavi ile ödediğimiz bedel her zaman çok düşük olmayabilir. Ne zaman bir hastamızı pozitif basınçlı mekanik ventilasyona başlatsak beraberinde
1. Alveoler ventilasyonun değişmesini
2. Alveoler kapiller perfüzyonun değişmesini
3. Surfaktanda fonksiyonel değişiklikleri
4. Transkapiller sıvı geçişine bağlı lenfatik drenajın bozulmasını
5. Venöz dönüşün azalmasını
6. Tüm yukarıdakilere bağlı artık daha zor ventile ettiğimiz bir akciğer ile uğraştığımızı
7. Organizmayı infeksiyona daha yatkın hale getirdiğimizi
8. Diğer organlarda hem kalp debisi azalması, hem lenfatik drenaj bozulması, hem de bozulmuş venöz dönüş nedeniyle fonksiyon kaybı yaşayacağımızı hatırlamamız gerekir….