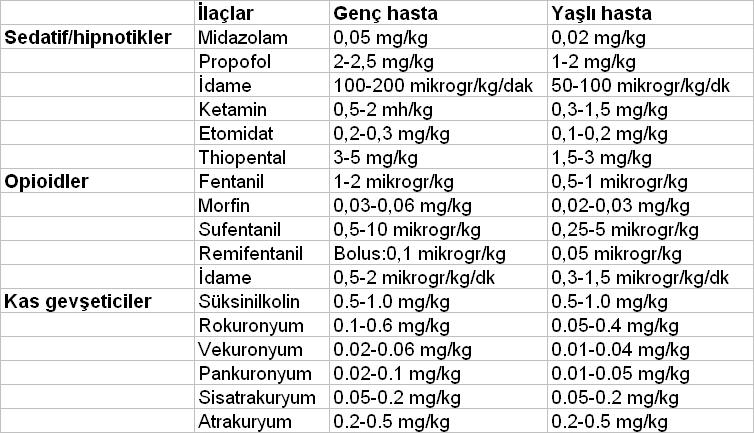
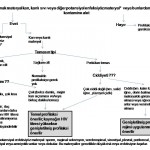
Atriyal Fibrilasyon (AF), birleşmiş atriyal kontraksiyonların tamamen yok olması halinde ortaya çıkan supraventriküler bir aritmidir.Atriyal fibrilasyon, kardiyak aritmiler arasında en sık rastlanandır ve primer klinik problem olarak ya da diğer akut tıbbi durumların (pnömoni, MI, sepsis) komplikasyonu olarak ortaya çıkar.
Atriyal Fibrilasyon EKG’sinde atriyum kasılması anlamına gelen P dalgaları görülmez.Eğer atriyoventriküler ileti sağlam ise, AF düzensiz ve hızlı sürekli bir ventriküler cevapla ile ilişkilendirilir.
Atriyal Fibrilasyon, atriyal flutter veya atriyal taşikardi gibi diğer aritmilerle de karıştırılabilir.Atriyal flutter EKG’si testere dişi şeklini ortaya çıkaran atriyal aktivasyonun daha düzenli ve organize halidir.
Atriyal Fibrilasyon için Risk Faktörleri:
- AF için en önemli risk faktörü yaştır.CABG sonrası AF oluşum riski 60 yaş hastalarda %18 iken 80 yaşta bu oran %50’ye çıkar.(Yaş ile atriyumda ortaya çıkan fibrozis ve lipid depolanması gibi değişikliklerin AF’yi tetiklediği düşünülür.)
- Hipertansiyon
- Diabetes Mellitus
- Var olan Kalp Hastalığı öyküsü (Sağ Koroner Arter Stenozu / Sol Ventrikül Hipertrofisi / Romatolojik Kalp Hastalığı Hikayesi ör; MS )
- Stroke / TİA Hikayesi
- Hipotiroidi
- KoAH
- Erkek cinsiyet
- Hipomagnezemi
- Preop Digoksin kullanımı
Atriyal Fibrilasyon Sınıflandırılması
1) AF oluşum şekli
2)AF tedavisine cevaba göre yapılabilir;
*Paroksismal AF (nöbetler şeklinde gelen): Genellikle dakikalarca veya saatlerce süren ve sonunda kendi kendine geçen , tekrarlayan vakalar oluşması halidir.
*Persistant AF (sürekli): Aritminin kendiliğinden düzelmemesi halidir.Sinus ritmine dönmesi için farmakolojik veya elektriksel kardiyoversiyon gereklidir.
* Lone AF: Kardiyovasküler hastalık öyküsü olmayan , EKG’sinde (AF dışında ) bir değişiklik olmayan ve PA AC grafisi normal olan hastalar iyi tolere edilen AF ile başvurursa, onları yapısal olarak normal kalp kaynaklı LONE AF olarak isimlendiririz.
PATOFİZYOLOJİSİ
AF’yi tetikleyen prematur bir supraventriküler atımdır.Bu atım re-entran bir yol kullanır.
Hücresel düzeyde ise bu değişiklikler aksiyon potansiyeli platosunu ve repolarizasyonu kısaltan K ve Ca kanalları ile açıklanır.
Cerrahi yapılmayan hastalarda ve postop hastalarda yüksek sempatik sistem aktivitesinin de AF gelişminde etkisi olduğu kabul edilmiştir.(Hatta sempatik sistem blokajı yapan Torakal Epidural Anestezi ‘nin postop AF gelişimini azalttığı düşünülür.)
TEDAVİDE MAJOR HEDEFLER
3 ana başlık altında toplayabiliriz.
1) İlgili semptom ve hemodinamik bozuklukları hafifletmek.
2) Sistemik tromboemboli riskini azaltmak
3) Hastaneye yatışı azaltmak veya önlemek
AF’ye YAKLAŞIMDA KABUL GÖREN 3 TEMEL AMAÇ
-
1) Kalp hızı kontrolü
-
2) Antikoagülasyon
-
3) Ancak üstteki iki amaca ulaşıldıktan sonra sinus ritmine döndürme (Elektriksel Kardiyoversiyon/ Farmakolojik Kardiyoversiyon)
AF tedavisinde ilk değerlendirme çok önemlidir.Öykü ve fizik muayeneyi takiben çekilen 12 derivasyonlu EKG ve PAAC grafisi bizim için yol göstericidir.Aynı zamanda glikoz, elektrolitler ve renal-tiroid fonksiyonları da gözardı edilmemelidir.
Bunlara ilaveten;
*AF’nin süresi
*AF’nin sınıflandırılması
*Eşlik eden semptomların ciddiyeti; hemodinamik instabilite
*Allta yatan Kardiyak hastalık
*Akut tetikleyiciler (SEPSİS, Solunum Sistemi Enfeksiyonları/Genel Anestezi/Mİ) de mutlaka sorgulanmalıdır.
EKO da kardiyak yapı ve fonksiyonları incelemek için en faydalı noninvazif araçtır.
AF Tedavisini başvuru zamanına göre sınıflandıracak olursak;
0-24 saat içinde başvuran hastalar
İyi tolere edilen ve/veya daha önce kendiliğinden sonlanmış bir atak öyküsü olan AF’li hastalar taburcu edilirler.Bu hastalar 24 saat sonra tekrar EKG kontrolü için çağırılırlar ve atak hala sonlanmamış ise kardiyoversiyon yapılır.(Çünkü Paroksismal AF’li hastaların çoğu kendiliğinden sinüs ritmine dönecektir. Bu 48 saatlik fırsat penceresinden faydalanırız.)
24-48 saat içinde başvuran hastalara yada kötü tolere edilen AF’lere:
Hemen kardiyoversiyon yapılmalıdır.
*Yapısal Kalp Hastalığı var ise; DC kardiyoversiyon
*Yapısal Kalp Hastalığı yok ise; Farmakolojik kardiyoversiyon planlanır.Başarısız olursa DC Kardiyoversiyon yapılır
Eğer Kardiyoversiyon başarılı ise doğrudan taburcu edilebilir.
AF hemodinamik kötüleşmeyi tetikliyor ise (yani altta yatan yapısal kalp hastalığı , Mİ varsa) hasta yatırılarak tedavi edilmelidir.
48 saatin üzerinde yada süresü belirsiz AF tedavisinde
Bu grupta kendiliğinden sinus ritmine dönüş olağandışıdır.
Hemodinamik olarak stabil hastalar Farmkolojik Hız Kontrolü +Warfarin yada Aspirin tedavisi verilerek EKO sonucu Elektriksel Kardiyoversiyona uygun ise uzun dönem Amiodaron veya Sotalol tedavisine başlanır; değil ise uzun dönem hız kontrolü ve Warfarin veya Aspirin tedavisine başlanır.
AF ciddi semptomları / hemodinamik bozuklukları presipite ediyor ise veya Mİ, Pnömoni gibi eşlik eden tıbbiproblemlerin tedavisi gerekiyor ise hastaneye yatırma endikasyonu olacaktır.
Bu gruptaki hemodinamik olarak unstabil hastalara ilk olarak farmakolojik hız kontrolü yapılmalıdır (iv Digoksin ve Amiodaron ile) . Düzelme sağlanamaz ise TEE rehberliğinde Kardiyoversiyon yapılmalıdır.Eğer bu hastalar farmakolojik kardiyoversiyona yanıt verirlerse 4 hafta antikoagülan tedavi ve takip sonrası sistemik tromboemboli riskini azalttıktan sonra elektif DC Kardiyoversiyon planlanır.
FARMAKOLOJİK KARDİYOVERSİYON
AF’u iyi tolere eden ve kalp hastalığı bulgusu olmayan hastalarda farmakolojik kardiyoversiyon denenebilir.Eğer başarısız olursa Elektriksel Kardiyoversiyon denenir.
Farmakolojik Kardiyoversiyon amaçlı kullanılan ANTİARİTMİK AJANLAR
SINIF I AJANLAR; Flekainid ve Propafenon sinus ritminin hızla sağlanması için en etkili ajanlardır.72 saatten kısa süreli AF’ lerde 0-3 saatlik 2mg/kg IV Flekainid infüzyonu %70-80 akut dönüşü sağlayacaktır.(Bu ajanlar yapısal kalp hastalığı varlığında göreceli kontrendikedirler.Özellikle İKH ve LV fonksiyon bozukluğu)
SINIF IA AJANLAR; Dizopiramid/Digoksin/Amiodaron/Sotalol
Digoksin; ventrikül hızını yavaşlatır fakat Akut AF dönüşümünü artırmaz.
Amiodaron; ile dönüşüm oranı sınıf IC ajanlara göre daha düşüktür fakat yapısal kalp hastalığı ve bozulmuş Sol Ventrikül fonksiyonu olan hastalarda güvenli olarak kullanılabilir.Ventrikül hızını düşürür , AF rekürrensine eğilimi azaltır.O halde Amiodaron kötü tolere edilen , hemodinamik olarak unstabil AF’li hastalarda DC K ardiyoversiyona ek faydalı bir ajandır.
SINIF3 ANTİARİTMİKLER; İbutilide / Dofetilide ; akut Kardiyoversiyonda sınıf IC ajanlardan daha düşük etkilidirler ve ciddi proaritmi sıklığı daha yüksektir.Fakat yapısal kalp hastalıklı hastalarda sınıf IC ‘ye göre daha güvenlidirler.
ANTİTROMBOTİK TEDAVİ
2 amaçla yapılır.
1)Acil yada planlanan KV ile ilişkili spesifik tromboemboli riskini azaltmak için
2)Hasta uzun süre AF’de kalacak ise AF ile oluşabilecek uzun dönem sistemik embolizasyon riskine karşı proflaksi amaçlı yapılır.
Erken Kardiyoversiyon düşünülen hastalara TEE rehberliğinde Heparin başlanmalı ardından 4hafta Warfarin verilmelidir. Kesin DC Kardiyoversiyon kararı verilen hastalarda 3-4 hafta öncesinden Warfarin tedavisi başlanmalıdır.(hedef INR:2,0-3,0). KV için karar sonraki takiplere ertelenecek ise sistemik embolizasyon riskinden korumak için Warfarin yada Aspirin tedavisi başlanmalıdır.
İpek Küseyrioğlu