Trakeal ekstübasyonu takiben gelişen solunumsal komplikasyonlar aslında indüksiyon ve entübasyona kıyasla 3 kat daha sıktır (%4.6 ya karşılık %12.6). Her ne kadar zor havayolu algoritmalarının oturması indüksiyon sırasında karşılaşılan problemleri azaltmışsa da ekstübasyon sırasında gelişen problemlerin sıklığı pek değişmemiştir. Bu yazıda da Karmakar ve Varshney, anesteziden çıkış ve trakeal ekstübasyon sonrası gelişebilecek sorunlara değinmektedir.
1. Trakeal ekstübasyon uyanık mı yoksa anestezi altında mı olmalı?
Ekstübasyon zamanına karar verilirken göz önüne alınması gereken 2 nokta bulunmaktadır:
– Daha önce havayolu kontrolünde bir güçlük yaşandı mı?
– Pulmoner aspirasyon riski nedir?
Genel bir kural olarak tüm hastalar uyanık ekstübe edilmelidir. Çok az sayıda pediatrik çalışmada uyanık ekstübasyonun artmış havayolu reaktivitesine bağlı üst havayolu komplikasyonu insidansını arttırdığı gösterilmiştir. Ancak bu kısıtlı çalışmalarda uyanıklık göstergesi olarak yutkunma kabul edilmiştir. Oysa ki, ekstübasyon gözler açık, spontan soluyan hastalarda gerçekleştirildiğinde havayolu komplikasyonları belirgin şekilde azalmaktadır. Derin anestezi altında ekstübasyon kardiyovasküler uyarılmayı ve öksürme ya da tüpe reaksiyon gösterme insidansını belirgin şekilde azaltmaktadır. Ancak bu şekilde ekstübasyon, operasyon cinsinden bağımsız olarak, solunumsal komplikasyonlarla beraberdir.
2. Ekstübasyon için hasta pozisyonu ne olmalı?
Anestezideki ilerlemelere rağmen perioperatif pulmoner aspirasyon riski ciddi şekilde azalmamıştır ve her 10,000 anestezi için 2.9 ila 10.2 insidansı bildirilmektedir. Aspirasyon yaşananlarda ise mortalite 0 ila 4.6 arasında değişmektedir. Geleneksel olarak kullanılan sol lateral baş aşağı pozisyonda ekstübasyonun temel gayesi de hem havayolunu aspirasyondan korumak, hem de dili posterior faringeal duvardan uzaklaştırarak havayolu açıklığını korumaktır. Tecrübeli anestezistler için bu pozisyonda gerekirse laringoskopi ve tekrar entübasyon kolaydır.
Sık kullanılan bir diğer yöntem supin, oturur / yarı-oturur pozisyonda ekstübasyondur. Özellikle zor entübasyonu gerçekleştirilen, obez veya kronik akciğer hastalığı olan hastalarda tekrar entübasyon için kolaylık sağlaması bu pozisyonu avantajlı kılar. Bu hastalarda ve yine havayolu cerrrahisi geçirmiş olanlarda, supin, yarı-oturur pozisyon spontan solunumu, diyafram ekspansiyonunu arttırır; etkili bir öksürük refleksini tetikler, fonksiyonel rezidüel kapasiteyi arttırır ve havayolu ödemini azaltacak şekilde lenfatik drenajı kolaylaştırır. Obstrüktif uyku apne sendromu olan hastalarda, yakın zamanda yayınlanan kılavuzda ekstübasyon için yarı-oturur veya lateral pozisyon (Supin pozisyon hariç diğer pozisyonlar) önerilmektedir.
Yüzüstü pozisyonda ekstübasyon spinal cerrahi sonrası gerekebilir, bunun için nöromüsküler kas gevşemesinin antagonizmasını takiben spontan solunumda, hastanın gözleri açık ve amaca yönelik hareketler yaptığında ekstübasyon tarif edilmiştir. Ancak bu teknik çok nadir kullanılmaktadır. Çocuklarda ise anestezi altında „recovery“ pozisyonunda ekstübasyon sık kullanılmaktadır.
3. Ekstübasyon zamanlaması ne olmalıdır?
Daha önce laringospazmdan sorumlu olan laringeal addüktör nöronların ateşleme eşiklerinin spontan solunumdan sinüzoidal şekilde etkilendikleri gösterilmiştir. Buna göre inspiryum sırasında glottis kapanması için gerekli ortalama eşik değeri artmaktadır. Bu nedenle ekstübasyon, glottisin tam açık olduğu inspiryum sonunda gerçekleşmelidir. Böylece laringospazm ve travma engellenebilir. Yine direkt laringoskopi, posterior farinksin temizlenmesi, inhalasyon ajanlarının yıkanması için ventilasyonun idamesi ve %100 oksijen verilmesi, ekstübasyon sırasında pozitif basınçlı bir soluk verilmesi ekstübasyon öncesi uygulanabilecek ve atelektaziyi engelleyen standart manevralardır.
4. Çift lümenli tüplerde ekstübasyon nasıl olmalıdır?
Çift lümenli tüp kullanımı posterior membranöz trakeada yırtıklar, bronşial rüptür ve uzun vakalardan sonra ekstübasyonda başarısızlıkla sonuçlanabilir. Özellikle anestezi sonlandırılırken, çift lümenli tüple eksitübasyon daha zordur; çünkü bu tüpler daha sert, daha büyük ve uzundur ve trakeobronşial travmaya neden olabilirler. Bu nedenle de postoperatif ventilasyon gereken veya uzamış ekstübasyon yaşanan hastalarda çift lümenli tüpler anestezi altında tek lümenli tüplere değiştirilirler. Bu değiştirme için oksijen insuflasyonuna izin veren içi boş trakeal tüp değişim kateterleri, veya yine insuflasyon çıkışları bulunan fiberoptik skoplar kullanılabilir. Bunun dışında tübüler fiberoptik skoplar da (örneğin Wu skopu) kullanılmaktadır.
5. Uyanma esnasında trakeal tüpün ısırılması nasıl engellenir?
Uyanma sırasında trakeal tüpü korumanın yollarından biri, anesteziyi yüzeyelleştirmeden önce bir orofaringeal Guedel havayolu yerleştirmek ve böylece tüpün ısırılmasını engellemektir. Alternatif olarak trakeal tüpün yerinde balonu (cuff) inik olarak bırakılması da, hasta tüpü ısırsa da tüpün etrafından nefes alınmasını sağlayacaktır. Yine eğer hasta tüpü ısırıyorsa sallanan dişlere, dolgu ve köprülere özellikle dikkat edilmelidir. Eğer hasta nazal entübe edildiyse, derlenme esnasında trakeal tüp nazofarinkse kadar geri çekilerek, nazofaringeal havayolu olarak kullanılabilir.
6. Ekstübasyon nerede gerçekleştirilmelidir?
Ekstübasyon için ideal yer ve uyanma odasına transfer için uygulamalar kurumdan kuruma çeşitlilik gösterir. İngiltere’de ekstübasyonların %65 ila 91’i ameliyathanede gerçekleşmektedir. Çalışmalar hastalara oksijen verilse de, ameliyathaneden uyanmaya kadar geçen transfer zamanında desatürasyonlar olduğunu göstermiştir. Uyanma odasına varıldığında hastaların %20’e dek varan kısmında satürasyonun %92’nin altında olduğu gözlenebilir. Yüz maskesiyle %40 oksijen solutulmalarına rağmen yine hastaların %15’inde 30 saniyeden uzun süren satürasyon düşüklükleri gösterilmiştir. Çocuklar transfer sırasında özellikle hipoksemiye eğilimli gruptur, %50’sinde uyanma odasına varışta satürasyonun %95’in altında olduğu gözlenmiştir. Bu nedenlerle, ameliyathaneyi terk etmeden önce hastalara %100 oksijen solutmak, transfer sırasında da yüksek konsantrasyonda oksijen verilmesine devam etmek önerilmektedir.
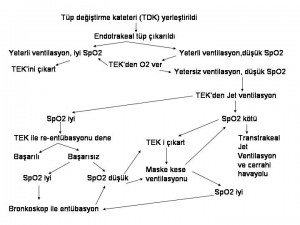
Ekstübasyonla ilişkili problemler:
1. Zor ekstübasyonun mekanik nedenleri
Trakeal tüpün çıkarılmasının mümkün olmaması hasarlanmış pilot balona bağlı olarak tüp balonunun indirilememesi, tüp balonunun fıtıklaşması, larinkste travma, trakeal duvara adhezyon, veya cerrahi olarak yanlışlıkla tüpün başka anatomik yapılara dikilmesi olabilir. Bunlara bağlı olarak pulmoner aspirasyondan ölümcül kanamaya kadar pek çok sonuçla karşılaşılabilir. Problem genelde tüp balonunun transtrakeal ponksiyonu veya pilot balonun kökünün iğne ile delinmesi, tüpe rotasyon ve traksiyon yapılması, tanı için fiberoptik skop kullanılması ve cerrahi olarak tüpü tutan dikişlerin alınması ile çözülür.
2. Kardiyovasküler cevap:
Trakeal ekstübasyonla beraber arter basıncında ve kalp hızında 5-15 dakika süren %10-30’luk bir artış gözlenir. Koroner hastalığı olanlarda ejeksiyon fraksiyonunda %40-50 azalma meydana gelebilir. Meydana gelen kardiyovasküler cevap esmolol (ekstübasyondan 2-5 dakika önce iv 1.5 mg/kg), nitrogliserin, magnezyum, propofol infüzyonu, remifentanil/alfentanil infüzyonu, iv lidokain (2 dakika içinde 1 mg/kg), topikal %10 lidokain ve perioperatif oral nimodipin ve labetalol ile azaltılabilir. Bir başka yol ise trakeal entübasyonun ekstübasyon öncesi LMA’ya dönüştürülmesidir.
3. Solunumsal komplikasyonlar:
Öksürme ve boğaz ağrısı insidansı %38-96 arasındaki geniş yelpazede dağılmaktadır. Bu sık komplikasyonu engellemek için çeşitli yollar önerilmektedir. Trakeal balonun sıvı ile doldurulması ısıdaki değişimler veya N2O diffüzyonu ile balonun aşırı şişmesini engeller. %2 lidokain çözeltisi ile birlikte %1.4 veya 8.4 NaHCO3 çözeltisi PVC kuffdan iyi bir diffüzyon kapasitesine sahiptir, güvenlidir ve özellikle %1.4 NaHCO3 çözeltisi kullanılıyorsa fizyolojik pH’ya daha yakın olduğu için tüpün balonunun patlaması halinde bile irritasyona neden olmaz. Bu teknik ilk 24 saatlik postoperatif dönemde belirgin şekilde boğaz ağrısını azalttığı, ekstübasyon esnasında yutkunma refleksini ortadan kaldırmadan öksürmeyi ve huzursuzluğu baskıladığı için özellikle kardiyovasküler hastalığı olanlarda, artmış intrakranyal veya intraoküler basıncı olanlarda veya pulmoner hiperreaktif hastalarda düşünülebilir. Tüp balonunun üstünde ve altında yer alan 10 delik vasıtasıyla ek bir pilot tüpün içinden trakeaya lokal anestetik instillasyonuna izin veren tüpler de bulunmaktadır (Laryngotracheal instillation of Topical Anaesthetic -LITATM, Sheridan, Hudson RCI).
Erken postoperatif hipoksemi ise yetersiz dakika hacmi, havayolu obstrüksiyonu, artmış ventilasyon-perfüzyon uyumsuzluğu, diffüzyon hipoksisi, hiperventilasyon sonrası hipoventilasyon, titreme, hipoksik pulmoner vazokonstrüksiyonun inhibisyonu, mukosilier disfonksiyon veya kardiyak debi azalmasına bağlı oluşabilir.
Rezidüel kas gevşeticiye bağlı uzamış blok da, postekstübasyon hipoksemisinin ana ya da yardımcı nedeni olabilir.
Havayolu obstrüksiyonu laringospazm, laringeal ödem, hemoraji, travma ve vokal kord paralizisi/disfonksiyonu ile oluşabilir. Laringospazmdan daha önceki yazılarda bahsedilmişti.
Laringeal ödemse özellikle yenidoğan ve süt çocuklarında ekstübasyonu takip eden ilk 6 saat içinde kendini inspiratuar stridor ile gösteren bir komplikasyondur. Supraglottik ödem epiglotu posteriora doğru iterek inspiryumda glottik açıklığı kapatır, retroaritenoidal ödem ise inspiryumda ses tellerinin abdüksiyonunu kısıtlar. Yenidoğanda sadece 1 mm’lik subglottik ödem bile laringeal yüzey alanını %35 azaltır. Ödem gelişmesi için risk faktörleri sıkı yerleşmiş tüp, entübasyon sırasında travma ve entübasyon süresinin 1 saatten uzun sürmesi, tüp ile öksürmeve cerrahi esnasında baş ve boyun pozisyonunu değiştirme olarak sıralanabilir. Tedavi için ılık, nemli, oksijen ile zenginleştirilmiş hava karışımı solutmak; 1/1000’lik nebülize epinefrin (0.5 mL/kg ile başlanır, maksimum 5 mL); deksametazon 0.25 mg/kg bolusun ardından 24 saat boyunca her 6 saatte bir 0.1 mg/kg); Heliox; çok ağır vakalarda daha küçük tüp ile entübasyon denenebilir.
Üst havayolu obstrüksiyonu hematom sonucu venöz ve lenfatik konjesyon ile laringeal ve faringeal ödem sonrası da gelişebilir. Bu durumda kanamanın kontrol altına alınması, tekrar entübasyon ve kısıtlayıcı dikişlerin açılması gerekebilir. Travma (aşırı aspirasyon, travmatik entübasyon) da havayoluna zarar verip üst hava yolu obstrüksiyonuna neden olabilir. Aritenoid kıkırdak dislokasyonu hem akut bir obstrüksiyona neden olabilir hem de sonrasında ses değişimi ve yutmada ağrı ile kendini gösterebilir. Bu durumda yumuşak bir şekilde aritenoidlerin yerine oturtulması, hastanın tekrar entübe edilmesi ve hatta uzamış bir entübasyon gerekebilir. Vokal kord paralizisi nispeten nadir bir havayolu obstrüksiyonu nedenidir. Bu genelde n. vagusu hasarlayan baş, boyun veya torasik cerrahi sonrasında gözlenir. Tek taraflı paralizi kendini erken postoperatif dönemde ses kalınlaşmasıyla belli eder ve etiyolojiye bağlı olarak haftalar içinde iyileştiğinden konservatif olarak takip edilir. Bilateral kord paralizisi ise kendini akut post-ekstübasyon obstrüksiyon nedeni olarak gösterir ve ivedi entübasyon gerektirir. Vokal kord disfonksiyonu ise nadirdir ve yakın zamanda üst solunum yolu infeksiyonu ve duygusal stres geçirmiş genç kadınlarda gözlenir. Hastalarda laringeal stridor veya astıma benzer wheezing duyulur ancak bronkodilatatör tedaviye cevapsızdır. Bazen tekrar entübasyon ve hatta cerrahi havayolu gerekebilir. Tanı inspiryum sırasında vokal kordların paradoksal hareketi ile konulur.
Post obstrüktif pulmoner ödem:
Post-obstrüktif pulmoner ödem genelde çocuklarda veya genç yapılı erişkinlerde gözlenir. Sıklıkla yaşanan derlenme esnasında bir havayolu obstrüksiyonunu takiben hızlı başlayan solunum güçlüğü, hemoptizi, pulmoner ödemle uyumlu radyolojik görünümdür. Hem klinik hem de radyolojik bulgular 24 saat içinde düzelir, ancak nadir de olsa ölüm veya akut akciğer hasarı ile sonlanan vakalarda bildirilmiştir. Patofizyolojide negatif alveol içi basınç, artmış kardiyak dolum ve pulmoner damarlardaki hasar sonucu kanama suçlanmaktadır. Bunun dışında hipoksemi ve katekolamin salınımının alveolokapiller geçirgenliği arttırması, volatil ajanların alveolar sıvı temizleme mekanizmasını bozması da öne sürülmektedir. Tedavi temelde pozitif basınçlı ventilasyon ve oksijenasyondur.
Trakeaomalazi:
Retrosternal tiroid , büyümüş timus, vasküler malformasyonlar veya uzamış entübasyona bağlı olarak trakeal halkalarda yumuşama ve erozyon gözlenebilir. Trakeomalazinin ilk işaretleri başarısız ekstübasyon, inspiratuar stridor veya ekspiratuar wheezing olarak sıralanabilir. Ekstübasyon öksürmeyi engellemek için derin anestezi altında ve havayolu açıklığı için CPAP uygulanarak gerçekleştirilebilir.
Pulmoner aspirasyon:
Ekstübasyon evresi aspirasyonların üçte biri bu dönemde geliştiği düşünülürse tehlikeli bir dönemdir. Yutkunma refleksi anestetik ajanlarla körelmiştir ve laringeal fonksiyonlar uyanık olan postoperatif hastada bile ilk 4 saatte yabancı maddeyi algılayamayacak şekilde bozulmuştur.