Etiket: asidoz
Travmaya Bağlı Koagülopatide Fibrinojenin Rolü
Ciddi kan kaybının olduğu travmalarda koagülopati önemli bir problem olarak karşımıza çıkar. BJA ağustos sayısında bu hastalarda hedefe yönelik tedavi üzerine bir editör makalesi ve bir de derleme yayınladı. Bu makalede travma sonrası süreçte gelişen fizyopatolojik olayların koagülopatideki rolüne ve fibrinojenin yerine değinilmekte:
Şiddetli travmaya bağlı koagülasyon defektleri, büyük kan kayıplarındaki pıhtılaşma faktörleri ve trombositlerin tüketimi, kristalloid ve kolloid replasmanı sonrası görülen dilüsyonel koagülopati gibi sebeplere dayanır. Ek olarak fibrinolitik sistem aktivasyonu veya hiperfibrinolizis, hipotermi, asidoz ve metabolik degişiklikler de koagülasyon sistemini etkiler. Majör kan kayıplarında fibrinojen, trombosit ve diğer koagülasyon faktörlerinden daha erken kritik değere ulaşır. Fibrinojen için eşik değerinin sınırları hala tartışma konusudur. Önceden tavsiye edilen 100mg/dl eşik değerinin yanı sıra, son klinik çalışmalardaki verilere göre 150-200 mg/dl altındaki fibrinojen değerlerinde per-operatif ve post-operatif kanamaya eğilim artmıştır. Yüksek fibrinojen değerlerinin kan kaybının miktarına göre değişen koruyucu etkisi vardır. Multipl travma hastalarında, bozulmuş fibrin polimerizasyonun erken dönemde ve effektif düzeltilmesi için öncelik fibrinojen konsantrasyonlarına verilmelidir.
Travmaya Bağlı Koagülopati
Travmaya bağlı koagülopatide, dissemine intravasküler koagülopati (DIC) den farklı olarak tüketimle beraber jeneralize intavasküler mikrokoagülasyon yoktur, bunun yerine kanamaya bağlı koagülasyon faktörlerinin ve trombositlerin kaybı görülür. Sonrasında ise geriye kalan prokoagülanların da kristalloid ve kolloidlerin verilmesinden sonra dilüe hale gelmesiyle fibrinojen polimerizasyonu direk olarak etkilenir. Hemostaz temel olarak artmış fibrinolizis, hipotermi, asidoz, anemi ve elektrolit bozukluklarından etkilenir; bunun yanı sıra hiperfibrinolizis, hipotermi ve asidoz fibrinojen polimerizasyonunu ve metabolizmasını etkiler. Kan kaybında fibrinojenin sentezindeki artış bu sırada artmış olan fibrinojen yıkımını kompanse edebilecek düzeyde değildir. Bu sırada hemostazı sağlamak için yeterli miktarda trombin ve koagülabl substratlara gereksinim vardır. Trombin için trombositlere, koagülasyon için ise fibrinojenlere ihtiyaç vardır. Trombin oluşumu yeterli miktarda olduğunda, fibrini stabilize etmek için fibrinojene dönüşür, bu da faktör XIII varlığında oluşan pıhtının sertliğini belirler.
Travma ve masif hemoraji sonrasında koagülopatiyi etkileyen şok ve asidozu engellemek için normovolemi sağlanması büyük önem taşır.
Kristalloidler koagülasyon sistemi üzerine dilüsyon etkisi vardır, Ringer laktatla yapılan replasmanla dokudaki hipoksi azalır fakat hemorajiye bağlı fibrinojen metabolismasındaki değişikliklere bir etkisi yoktur.
Jelatin ürünlerinin hem dilüsyon hem de fibrin polimerizasyonunu bozma etkisi vardır. Kristalloidlere kıyasla pıhtı elastisitesinde ve ağırlığında azalma ve von Willebrand faktörde düşme etkisi olduğu önceki çalışmalarda bildirilmiştir.
Hidroksietil nişasta (HES) kullanımı, özellikle yüksek molekül ağırlıklı, yüksek substitüsyon oranlı ürünler, hemorajiye eğilimi arttırabilir. HES hipokalsemi, trombositlerin üzerinde tabakalaşma, fibrinojen reseptör blokajı (GPIIb-IIIa), von Willebrand tip-1 benzeri sendroma yol açabilir; fibrin polimerizasyonunda yarattığı bozulma jelatinlerin antikoagülan etkisinden daha fazla olabilir.
Travma hastalarındaki hiperfibrinolizisin derecesi hakkında kesin bir tahmin yapılamamakla beraber travmanın şiddetine ve etkilenen organ sistemlerine bağlı olarak değişiklik gösterir. Doku ve endotel hasarı koagülasyon sistemini aktive eder, bu da doku plasminojen aktivatörü (t-PA) ve antagonisti olan plasminojen aktivatör inhibitörü tip-1’in (PAI-1) salınımına yol açar. Başlangıçta, t-PA deki artış PAI-1 dekinden fazla olduğu görülmektedir. Yapılan bazı çalışmalarda travma sonrası dönemde fibrinolizisin bazı moleküler göstergelerinde yükselme bazılarında ise azalma gözlenmiştir. Hiperfibrinolizisde hemorojiye olan eğilim fibrinojen konsantresi ya da kriyopresipitat verilmeden önce sadece antifibrinolitiklerle tedavi edilebilinir. Antifibrinolitiklerin etkinliği kardiyak, ortopedik ve karaciğer (transplantasyon) cerrahisinde tanımlanmıştır, ancak şiddetli travmaya bağlı vakalarda veriler yetersizdir.
Travma ve kan kaybına bağlı gelişen asidoz , koagülopati oluşumunda en önemli prediktördür ve şiddetinin artışıyla beraber mortalite artar. Asidoz koagülasyon üzerine zararlı etkileri enzim aktivitesinde bozulma, fibrinojen ve trombosit seviyesinde azalma, pıhtılaşma zamanında uzama ve artmış kanama zamanıdır.
Fibrinojen seviyesindeki azalmanın mekanizması üzerine domuz modeliyle yapılan çalışmada, asidozun fibrinojen sentezi üzerine bir etkisi olmadığı ama yıkımını arttırdığı görülmüştür.
Şiddetli travmalarda genellikle 34°C’nin altında bir hipotermi görülmektedir. Hipotermi ve anormal koagülasyon arasında sıkı bir ilişki tanımlanmıştır. “Injury severity score” (ISS) >25 olan bir travma hastası grubunda vücut ısısı 35°C’den 32°C’nin altına düştüğünde, mortalitenin %10’dan %100’e çıktığı gözlenmiştir. Bu hastaların yaklaşık %80’i vücut ısısı <34°C iken hayatta kalamamıştır. Hipoterminin koagülasyon üzerine bilinen olumsuz etkileri uzamış protrombin zamanı ve aktive parsiyel tromboplastin zamanıdır. Domuz modellerinin vücut sıcaklığını 32°C’ye düşürerek yapılan bir çalışmada hipotermin fibrinojen sentezini azalttığı, fibrinojen degradasyonuna etki etmediği gösterilmiştir.Fibrinojen sentezi ve degradasyonu farklı mekanizmalarla regüle edilmektedir; hipotermide fibrinojen sunumunda potansiyel bir eksiklik olmaktadır.
Uluslarası önerilere göre travma veya cerrahi sonrası kanamalarda, trombosit sayısı 50.000/µl’in altına düştüğünde trombosit konsantreleri ile replasman yapılmalıdır. Trombositlerin eksikliği esas olarak pıhtının sertliğini etkiler, ayrıca bu durum fibrinojen seviyesindeki azalmadan da etkilenir. Bireyin ihtiyacına göre replasman tedavisinin belirlenmesi için, fibrinojen polimerizasyonunuyla ilişkili olan pıhtı dayanıklılığının trombelastografik (TEG®)/trombelastometrik (ROTEM®) ölçümleri bize değerli bilgiler sağlar. Fibrin polimerizasyonu ne kadar güçlü olursa, pıhtı dayanıklılığına katkıda bulunan trombosit sayısındaki azalmayı o kadar kompanse edebilir. İnflamasyona bağlı artmış fibrinojen değerleri olan trombositopenik hastalarda TEG®/ROTEM® monitorizyonundaki değerlere göre pıhtı sertliği normal değerlerde olduğu için trombosit replasmanına gerek olmamıştır.
Hayvan çalışmalarına göre fibrinojen konsantreleri, plasebo veya 3 günlük aferez trombosit konsantrelerine kıyasla pıhtı sertliği daha fazla arttırmaktadır. Kontrol edilemeyen kanamada fibrinojenle tedavi edilen hayvanların, trombosit konsantreleri veya plaseboyla tedavi edilenlere kıyasla kan kayıpları daha azalmakta, sağkalım süreleri uzamaktadır.
Koagülasyon bozukluklarında, kanama odağı cerrahi olarak kontrole alınmadan tedaviye başlanmamalı gibi düşünülse de, bunun hemostatik süreci geciktirip cerrahiyi daha zor hale sokabileceği ve yaralanma olmayan organlarda da mikrovasküler kanama oluşturabileceği konusunda karşı iddialar bulunmaktadır.
Masif kanamalı politravma hastalarında dilüsyonel koagülopati, hipotermi ve asidoza bağlı olarak fibrinojen erken dönemde kritik seviyelere ulaşabilir. Kolloidler küçük miktarlarda (>1000ml) bile fibrin polimerizasyonunu bozabilir. Normovolemik dilüsyon, eritrosit süspansiyonu ihtiyacı daha doğmadan bile fibrinojen değerlerinde kritik değişimlere sebep olabilir. Yukarıda tartışıldığı üzere, kritik fibrinojen değeri açıklığa kavuşmamıştır. Yapılan bazı önerilerde 100mg/dl veya 50mg/dl’nin yeterli olduğu belirtilmiştir. Ancak yüksek ve düşük plazma fibrinojen ölçümlerinin hala standardize olmadığı, kolloid kullanımında, özellikle HES ile, ölçüm hatalarının olduğu dikkate alınırsa bu öneriler değerini kaybetmektedir.
Fibrinojen konsantrelerinin etkileri havyan modellerinde incelenmiştir. kullanılmıştır. Domuz modelinde tahmini total kan hacminin %65’i alınıp jelatin ile replase edilerek dilüsyonel koagulopati oluşturulmuştur ve sonrasında fibrinojen konsantresi veya plasebo verilmiştir. Fibrinojen konsantresi ile yapılan replasman sonrası bozulmuş pıhtı sertliğinin normalize olduğu görülmüştür. Karaciğerde insizyonla oluşturulan kanamada, fibrinojen konsantresi alan hayvanlarda istatiksel olarak anlamlı oranda daha az kan kaybı gözlenmiştir.
Jinekolojik, nörocerrahi ve kardiyak cerrahilerdeki klinik verilere göre, fibrinojen seviyeleri 150-200mg/dl’nin altına indiğinde peri-operatif ve post-operatif hemorajik eğilim artmaktadır. Fibrinojen konsantrelerinin, edinilmiş eksiklikteki etkinliği üzerine klinik veriler ise kısıtlıdır. Klinik kullanımındaki gözlemsel rapor ve retrospektif veri analizlerinin sonuçlarına göre fibrinojen konsantresi, azalmış dayanıklılıktaki pıhtıyı stabilize edebilmektedir. Ciddi yaralanması olan ve masif transfüzyon yapılan 252 askerin yer aldığı retrospektif bir çalışmada, verilen fibririnojen miktarının (kriyopresipitat ve TDP kombinasyonu) sağkalımla korelasyon gösterdiği belirtilmiştir.
Yapılan diğer prospektif 4 çalışmada ise fibrinojen konsantresinin kullanımının (2 çalışmada ROTEM®), koagülasyonu optimize ettiği, peri-operatif kanamayı %32 azalttığı ve transfüzyon ihtiyacını düşürdüğü gösterilmiştir.
Özetle, dolaşımdaki yüksek fibrinojen kan kaybında koruyucu bir etki göstermektedir. Klinik pratik kullanımda TEG® veya ROTEM® monitorizasyonu koagülasyonun monitörize edilmesini ve yönetimini kolaylaştırmaktadır. Transfüzyon ihtiyacı olan kanamada, FIBTEM® analizinde maksimum pıhtı sertliği (MCF) 10-12 mm altında ise (10 dk değeri <7mm) fibrinojen konsantresi (veya kriyopresipitat) verilmelidir. Eğer ROTEM® monitörizasyonu mümkün değilse, fibrinojen plazma seviyeleri minimum 150-200mg/dl değerlerinde tutulmalıdır
Sonuç olarak, fibrinojen mevcudiyeti sentez ve yıkım arasındaki dinamik değişikliklere göre düzenlenerek koagülasyon fonksiyonu ayakta tutulur. Son zamanlardaki çalışmalarda fibrinojenin travmaya bağlı koagülopatideki rolü gösterilmiştir. Hemodilüsyon, hiperfibrinolizis, hipotermi ve asidoz fibrinojen düzeyini azaltır ve koagülasyon sürecinde bozulma meydana getirir. Yakın gecmişteki çalışmalarda travma hastaları ve hayvan modellerinde fibrinojen verilmesinin yararlı olduğu gösterilmiştir. Ancak daha fazla çalışma gerekmektedir.
Burcu Mert
Hiperkapnik Asidoz
Hiperkapnik asidoz (HKA), önce akciğer rezeksiyonları sonucu ortaya çıkan respiratuar problemlerin şiddetini belirtmek üzere “tolere edilebilir hiperkapni” tanımı ile literatüre girmişti. ALI ve ARDS çalışmalarında elde edilen verilerden sonra HKA artık “terapötik hiperkapni” kavramına dönüşmüş durumda. Anesthesiology’de çıkan bir editöryel makale konuya farklı boyutları ile değinmekte.
HKA’un pek çok etkisi ortaya konuldu. Bunların bir bölümü pozitif bir bölümü ise negatif etkiler. HKA’un doku hasarını azaltıcı etkilerinin yanı sıra doku oksijenasyonunu arttırıcı etkisi de klinik olarak gösterilmiş durumda. Bunu kalp debisini arttırma ve vazodilatasyonu indükleme yoluyla sağlamakta. Buna karşılık akut hiperkapninin bakteriyal infeksiyona bağlı akciğer hasarını kötüleştirdiği ve lipopolisakkaritlere bağlı akciğer hasarına da katkıda bulunduğu düşünülmekte. Gene akut hiperkapni kas fonksiyonunu da bozmakta, diyafragma kontraktilitesini azaltmakta . Bu istenmeyen etkiler hiperkapninin derecesi ve süresi ile doğru orantılı olarak ortaya çıkmakta.
Akut akciğer hasarı (acute lung injury, ALI) ve akut respiratuar distres sendromu (ARDS) verilen büyük uğraşlara rağmen hala yüksek mortaliteye sahip klinik tablolar. Klinik çalışmalar “koruyucu ventilasyon stratejileri” uygulanan hastalarda sonucun daha olumlu olduğunu gösterdi. Koruyucu ventilasyon stratejilerinde amaç düşük tidal volüm ile ventilasyonu sağlayarak akciğerin gerilimini ve bunun yarattığı hasarı azaltmak olarak özetlenebilir. Bu stratejide bir yan etki olarak ortaya çıkan ve genellikle rahat tolere edilen hiperkapninin akciğerde oluşan hasarın modülasyonunda payı olmadığı, sekonder pasif bir fenomen olduğu düşünülmekteydi. Oysa çalışmalar indüklenen hiperkapnik asidozun (HKA) akciğer hasarında direkt koruyucu etkisi olabileceğine dair kanıtlar ortaya koydu. HKA’un koruyucu etkisi kısmen, hücresel immün fonksiyonlarda baskılanma, serbest radikal oluşumu ve oksidanlara bağlı doku hasarının azalması gibi antiinflamatuar etkilere bağlı gibi görünmekte. Hatta hasarda anahtar rol oynayan tümör nekrotizan faktör-alfa (TNF-alfa), interlökin-1 (IL-1) ve IL-8 düzeyleri de HKA’a bağlı olarak azalmakta. Dolayısı ile ılımlı HKA’un, kritik hastalarda terapötik etkili olduğu açık.
Konu ile ilgili pek çok çalışma yapılmakta. Bunlardan birisinde E. coli pnömonisi oluşturulan sıçanlarda FiCO2=0.05 verilerek oluşturulan HKA’un, pnömoni sonrası artan peak hava yolu basınçlarını ve statik akciğer kompliyansını düşürdüğü gösterildi. Aynı çalışmada hayvanlara antibiyotik de verildiğinde HKA’un pnömoniye bağlı histolojik hasarın boyutunu belirgin şekilde azalttığı saptandı.
Nötrofiller enfeksiyona cevapta önemli bir komponent. HKA’nın endoktoksine bağlı akciğer hasarında nötrofil infiltrasyonunu ve nötrofillerin kemotaktik ve bakterisidal etkilerini baskıladığı saptanmıştı. Dolayısı ile HKA’un akciğer hasarını azaltıcı etkisinin nötrofil inhibisyonuna da bağlı olduğu düşünülmüştü. Ancak yakın tarihli bir çalışma HKA’un akciğer hasarını nötrofillerden bağımsız olarak azalttığını da gösterdi. Bu çalışmalarda dikkate alınması gereken nokta HKA’un hasar başladıktan sonra uygulanması.
Çalışmaların düşündürdükleri:
Şu ana dek elde edilmiş sonuçlara göre HKA’u geleceğin terapötik ajanı olarak düşünürsek, bunu ALI hastalarında uygulamalı mıyız? Bu adıma geçmeden cevaplanması gereken birkaç soru var:
* HKA’u ılımlı bir hipoventilasyon ile mi oluşturalım, yoksa bazı çalışmalarda olduğu gibi CO2’yi inspiryum havasına ekleyerek mi sağlayalım? Bir hayvan çalışmasından elde edilen sonuçlara göre protektif ventilasyon stratejisi uygulandıktan sonra tidal volümü veya solunum frekansını HKA sağlamak için daha fazla azaltmak anlamsız; terapötik hiperkapninin antiinflamatuar etkilerini elde etmek için inspiratuar CO2’den yararlanmak daha iyi bir yol olabilir denmekte. Çünkü hipoventilasyon stratejisi nedeniyle az ventile olan alanların CO2’den yararlanması daha az olmakta; buna karşılık daha iyi bir ventilasyon sırasında CO2 inspire ettirildiğinde, CO2 akciğerde daha homojen dağılım gösterebilmekte.
* İkinci soru ise HKA’un protektif etkilerinin hiperkapniye mi yoksa asidoza mı bağlı olduğu. Protektif etki kısmen ksantin oksidaz inhibisyonuna bağlı gibi görünmekte ve asidoz tamponlandığında ortadan kalkmakta. Peki metabolik asidozun doku hasarı açısından benzeri etkileri var mı?
* Bir diğer soru HKA’un süresinin ne kadar olması gerektiği. Sınırlı süre HKA iyi olmakla beraber, sürenin uzaması ters etkiler gösterebilir. Nitekim 2 günlük HKA’un bakteriyal kökenli akciğer hasarını bakteriyal yükü arttırarak kötüleştirdiği gösterildi.
Toparlayacak olursak eldeki verilere göre, sınırlı süre için orta dereceli hiperkapni belirgin yan etkilere yol açmadan ALI’nin şiddetini azaltabilmekte. Ancak ortaya çıkan soruların cevaplanması için daha fazla çalışmaya gerek olduğu kesin.
Laktat Metabolizması
Güncel Anestezinin son iki bölümü pediatrik hastalarda peroperatif sıvı idamesi ve replasmanı üzerineydi. Kafalar berraklaşacağına daha çok karıştı sanırım. Konu henüz netlik kazanmış değil. Laktat metabolizması ve karaciğer fonksiyonları dikkate alındığında pediatrik grupta ringer laktat problem yaratabilir mi diye bir sürü literatür karıştırdım. Çocukta sıvı resüsitasyonunda kristalloid seçilecekse salin ve ringer laktat öneriliyor (British Journal of Anaesthesia, CEPD Reviews, Volume 3 Number 1, 2003).
Erişkinde ringer laktatın içeriğinin fizyolojik elektrolit düzeylerine daha yakın olduğu ve büyük miktarlarda sıvı resüsitasyonunda hiperkloremik asidoza yol açan saline oranla üstünlüğü ve ilk seçenek olması gerektiği bildirilmiş (Continuing Education in Anaesthesia, Critical Care & Pain, Volume 4, Number 4, 2004). Öte yandan hemorajik şokta çok miktarda eksojen laktat (ringer laktat solüsyonu) kullanılarak resüsite edilen erişkinlerde kan laktat düzeyinin şoka bağlı laktat artışından daha fazla olduğu da bildirilmiş (Anasthesiol Intensivmed Notfallmed Schmerzther 2002, 37:356). Gelecekte laktatsız solüsyonların daha yaygın kullanılacağı düşünülüyor.
Travma hastalarında hastaneye girişte bakılan laktatın sürvi için prognostik olduğu çok sayıda çalışma ile belirlenmiş. Sıvı resüsitasyonu için kullanılan ringer laktat bu değeri etkileyip yanıltıcı olabilir mi deniyor (Critical Care 2005, 9:441-453).
Günlük laktat döngüsü 1300 mmol/24 saat olabiliyor. Laktat karaciğerde glukoneogeneze girip metabolize ediliyor, hidrojen iyonları kullanılıyor, bikarbonat ise asidozu düzeltmede işe yarayabiliyor. Kritik hastada bu metabolik yol bozulursa veya artan bikarbonatın renal atılımı etkilenirse (kritik hastaların bir kısmı zorunlu asidik idrar üretiyor) alkaloz ve hipokalemi gelişebiliyor. Diabetes mellitusta ise şeker kontrolü kötü vakalarda laktatın glukoza dönüşümü ile glukoz düzeyi artacağından ringer laktattan kaçınılması gerekiyor (Continuing Education in Anaesthesia, Critical Care & Pain, Volume 5, Number 5, 2005).
Laktatın hepatik metabolizması 100 mmol /saat; akut renal yetersizlikte ise bu 0.6 mmol/kg/saat’e düşebiliyor (Intensive Care Med 1999; 25: 1209). Ringer laktatta 29 mmol/L olduğu düşünülürse hemodinamisi iyi normal hastada peroperatif replasmanda kullanımı sorun yaratmayacaktır. Ciddi karaciğer hastalığında metabolik hızı düşeceğinden ringer laktat seçilecek sıvı olmamalı. Öte yandan karaciğer transplantasyonunda özellikle anhepatik fazda laktatın böbrek fonksiyonları iyi hastada beklendiği oranda artmadığı biliniyor ve bu da renal laktat metabolizmasına bağlanıyor.
Bu uzun girişten sonra gelelim yeni konumuza:
Plazma laktat konsantrasyonunun normal değeri 0.3-1.3 mmol/L ve laktat üretimi ile laktat metabolizması arasındaki dengeyi ifade ediyor. İnsanda laktat L-isomeri halinde bulunuyor.
Normal Laktat Üretimi
Laktat üretiminin kaynağı eritrositler, perivenöz hepatositler, iskelet kası miyositleri ve cilt. Bazal üretilen miktar ise 0.8 mmol/kg/saat (1300 mmol/gün).
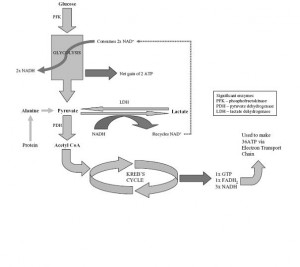 Figür 1‘de (solda) glikoliz ve laktat üretimi görülmekte.
Figür 1‘de (solda) glikoliz ve laktat üretimi görülmekte.İki yöntem kullanılıyor: Spektrofotometrik yöntemle proteinden arınmış kanda ölçüm veya kan gazı analizörlerinde ölçüm. İkinci yöntem laktatı %13 kadar yüksek ölçüyor, ancak sonuç hematokrite göre düzeltilirse bu fark azalıyor. In vitro eritrosit glikolizi devam ettiğinden tam kanda ölçülen laktat yanlış yüksek çıkıyor; dolayısı ile hemen ölçüm yapılmayacaksa kanın soğutularak veya proteinleri presipite ettirilerek ya da glikoliz inhibitörleri eklenerek stabilize edilmesi şart.
Laktat ve Laktik Asidoz
Laktik asitten dissosiye olan H+ iyonları oksidatif fosforilasyon ile ATP üretiminde kullanılabilmekte. Laktat üretimi devam ederken oksidatif yolda bozukluk olursa H+ iyonları artıp asidoza yol açıyor. Ağır egzersiz sırasında oksidatif fosforilasyonun devam etmesi ciddi boyuttaki laktat üretimine rağmen asidoz gelişmesini engelliyor.
NADH ve NAD+
Glikoliz NAD+ (nikotinamid adenin dinukleotid) üretimini gerektirir. NADH sunumu piruvatın laktata dönüşüm hızını denetler. Kalp gibi çok miktarda ATP gerektiren dokuların piruvatın asetil CoA’ya dönüşümüne gereksinimi vardır. NADH düzeyini düşük tutmak için mitokondrial membranda elektronların taşınmasına yardım edecek ve NADH’yı NAD+ haline okside edecek taşıyıcılar kullanılır. Malat-aspartat yolu temel taşıyıcı mekanizmadır. Gliserol-fosfat taşıyıcı yolu ise sekonder role sahiptir. Bu ikisi oks-fos taşıyıcı olarak bilinir.
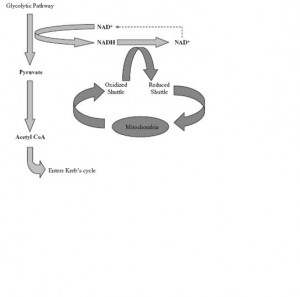 Figür 2‘de (solda) oks-fos taşıyıcı sistemi görülmekte.
Figür 2‘de (solda) oks-fos taşıyıcı sistemi görülmekte.
Glikoliz hızı oks-fos taşıyıcı sisteminin kapasitesini aşacak ölçüde artarsa NADH konsantrasyonu artar ve laktat üretimi ile NAD+’yı rejenere eder; sonuçta laktat konsantrasyonu yükselir.
Karaciğer laktatın %70’ini temizler. Karaciğerin laktatı alması hem bir monokarboksilat taşıyıcısı hem de daha az olarak difüzyonla olur (>2 mmol/L düzeyindeki konsantrasyonlarda önemli). Periportal hepatositlerde laktat glukoneogenez ve daha az olarak da CO2 ve suya oksidasyon şeklinde metabolize edilir. İskelet ve kalp kası miyositleri gibi mitokondriden zengin dokular ve proksimal tubulus hücreleri laktatın kalanını piruvata dönüştürerek uzaklaştırır. Bu işlem için oks-fos taşıyıcı sisteminin sağladığı NAD+ gereklidir. Laktatın %5’den azı ise renal yolla atılır.
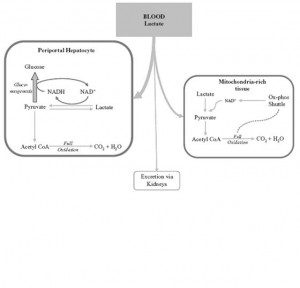 Figür 3‘de (solda) laktatın plazmadan uzaklaştırılması şematik olarak izlenmekte.
Figür 3‘de (solda) laktatın plazmadan uzaklaştırılması şematik olarak izlenmekte.1. Laktat Üretiminde Artış
Hiperlaktatemi (> 5 mmol/L) Tip A (doku hipoksisi tüketimden fazla laktat üretimine neden olur) ve Tip B (doku hipoksisinin rolü yok) olarak olarak ikiye ayrılmaktadır. Tip B’nin de nedene göre 3 tipi vardır: B1 (altta yatan hastalığa bağlı), B2 (ilaç ve toksinler), B3 (doğumsal metabolizma bozuklukları). Ancak bu klasifikasyon olayı basite indirgemektedir, oysa kritik hastadaki problem genellikle multifaktöryeldir.
Artmış glikoliz: Glikoliz artışının sağlanabilmesi için piruvatın laktata dönüşümünde ortaya çıkan NAD+’a gerek vardır. Fosfofruktokinaz (PFK) aktivitesi hız sınırlıdır. Hipoksemi, anemi, hipoperfüzyon, ağır egzersiz ve karbon monoksit intoksikasyonu gibi durumlarda ATP miktarının azalması, AMP miktarı artışına paralel olarak PFK’ı stimüle eder. Ayrıca endojen ve eksojen katekolaminler de glikolizi stimüle eder.
Ağır egzersizde tip II miyositler büyük miktarda laktat üretir (konsantrasyon 25 mmol/L’ye ulaşabilir, soruna yol açmaz). Bu artan kardiyak enerji gereksiniminin bir miktarını karşılar. Ağır egzersizi takiben gevşeme döneminde tip I kas lifleri artmış laktat metabolizmasından sorumludur.
Metabolizma bozuklukları: Doğumsal metabolik bozukluklar, tiamin eksikliği ve endotoksin varlığında piruvat dehidrogenaz aktivitesi bozulur. Kritik hastalık veya malignitede oluşan protein katabolizması alanin üretir ve bu da piruvata dönüşür. Krebs siklüsünün veya elektron transport zincirinin herhangi bir defekti piruvat birikimine neden olur.
2. Hepatik Laktat Klerensinin Azalması
Karaciğer kalp debisinin %25’ini alır. Portal ven hepatik kan akımının %75’ini, oksijenin %50-60’ını sağlar. Hepatik kan akımında veya oksijenasyonunda değişme veya intrensek karaciğer hastalığı karaciğerin laktatı metabolize etme kapasitesini etkiler.
Karaciğer kan akımı normalin %25’ine düşerse laktat klerensi azalır. Ağır şokta monokarboksilat taşıyıcısı tarafından laktat alımı satüre hale gelir, intrasellüler asidoz gelişiminde glukoneogenez inhibe olur ve azalmış karaciğer kan akımı metabolize edilmek üzere daha az laktat taşır. Anaerobik şartlarda hepatik enerji üretiminin temel biçimi glikolizdir. Böylece karaciğer laktatı glukoneogenez için kullanan organ yerine laktat üreten organ haline gelir.
Oral hipoglisemik ilaçlar: Laktatı piruvata dönüştürmek için gerekli NAD+’yı glukoneogenez sağlar. Biguanid oral hipoglisemik ilaçlar hepatik ve renal glukoneogenezi inhibe eder (metformin sadece renal yetersizlikte laktat metabolizmasını etkiliyor gibi görünmektedir). Metformin renal ve hepatik yetersizlikte kontrendikedir. NAD+ sunumu alkol dehidrojenaz gibi diğer enzim sistemlerinin tüketimine hassastır (etanol intoksikasyonunda bu enzimin aktiflenmesi ile belirgin hale gelir). Tip I diabette glukoneogenez bozulur.
Hartmann solüsyonu: Bu solüsyonun güçlü iyon farkı (SID) 28 mEq/L’dir. SID değerinin 0 olduğu %0.9 NaCl solüsyonuna göre normal değer olan 40-42 mEq/L’ye daha yakındır. Bu nedenle %0.9 NaCl’e göre daha az hiperkloremik asidoza yol açar. Laktat (29 mmol/L) güçlü iyon olarak etki gösterdiğinden karaciğer tarafından metabolize edilene dek geçici olarak asidoza yol açar.
3. Sepsis
Her ne kadar endotoksine veya travmaya cevap olarak fagositik hücrelerde aşırı laktat üretimi hiperlaktatemiye neden olsa da, hepatik laktat ekstraksiyonu ve utilizasyonundaki azalma da olaya katkıda bulunmaktadır.
4. Kronik Hastalık
Kronik hastalıklı karaciğerin laktatı işleme yeteneğindeki azalma periferik üretim arttığında veya karaciğerde daha fazla hasar oluştuğunda belirgin hale gelir.
5. Ekstrahepatik Metabolizmanın Azalması
Oksijen sunumunda azalma veya oksidatif yollarda intrensek bir problem olduğunda mitokondriden zengin dokuların laktatı metabolize etmesi azalacaktır. Bu durumda laktat tüketen değil üreten organlar haline geleceklerdir.
6. Renal Atılımın Azalması
Böbrekler laktatı ekskresyon, glukoneogenez ve oksidasyon biçiminde işlerler. Renal eşik 6-10 mmol/l’dir. Renal ekskresyon sadece hiperlaktatemide önemli hale gelir.
Laktat ve Kritik Hastalık
Ciddi asidoz (pH<7.35)> 5 mmol/L olduğunda mortalite %80’dir.
1. Kardiyak Arrest ve Resüsitasyon
Kardiyak arreste veya ağır hipovolemiye bağlı hipoksi anaerobik metabolizmayı tetikler. Laktat düzeyi direkt olarak hücre hipoksisini yansıtır. Hastane içi kardiyak arrest sırasında ve spontan dolaşımın başlamasından 1 saat sonra bakılan laktat düzeyi sürvi için prediktiftir.
2. Sepsis
Sistemik inflamatuar cevap sendromunda (SIRS) veya erken sepsiste hiperlaktatemi doku hipoksisini yansıtabilir. Oksijen sunumunun erken dönemde arttırılabilmesi sonucu iyileştirebilir. Sepsis tablosu oturduktan sonra bakılan laktat düzeylerinin yorumlanması zordur. Stabil septik hastaların oksijen sunumu artmıştır; doku oksijen düzeyleri genellikle anaerobik metabolizmayı tetikleyen düzeyin üzerindedir. Bozulmuş laktat klerensi genellikle artmış üretimden daha önemlidir. Bu hastalarda aerobik laktat üretimi stres altında karbonhidrat metabolizmasının değişimine bağlı olabilir. Dikloroasetat piruvat dehidrogenaz aktivitesini arttırarak ve septik hastada kan laktat düzeyini düşürmektedir, ancak hemodinami veya sürvi üzerine etkisi yoktur.
3. İntestinal İnfarkt
Barsak hipoksisi anaerobik metabolizmaya yol açar. Karaciğere portal ven üzerinden daha fazla laktat ulaşır. Başlangıçta peripotal hepatositler laktatı okside eder veya glukoza çevirir. Bakteriyel translokasyon ve ciddi sıvı kaçağı dolaşım kollapsına katkıda bulunur. Global olarak oksijen sunumu azalır. Endojen katekolamin salgılanması dolaşımı ayakta tutmaya çalışır, ama aynı zamanda glikoliz ve laktat oluşumunu da arttırır. Şok geliştiğinde hepatik kan akımı azalır intrasellüler asidoz laktattan glukoneogenez oluşumunu inhibe eder. Karaciğerde laktat klerensi yerine üretimi baskın hale gelir. İntestinal bakteriler glukozu ve karbonhidratı D-laktat’a metabolize eder. Bu ise insan LDH’ı tarafından yavaş olarak metabolize edilebildiğinden ve laktik asidoz oluşumuna katkıda bulunur.
Kritik Hastada Asit-Baz Bozukluklarına Alternatif Yaklaşım
Klinikte geleneksel olarak asit-baz bozukluklarının yorumu Sorensen’in ortaya koyduğu pH değerlendirmesi ve Henderson-Hasselbalch’in (H-H) PCO2/bikarbonat modeli ile yapılmaktaydı. Ancak bazı hastalarda bu yöntem asit-baz bozukluğunun ağırlığını ve kompleks halini değerlendirmeye ve patofizyolojisini anlamaya yetmemekte. CEACCP 2007’de çıkan bir derleme geleneksel yaklaşımın yetersizliğini ve Stewart‘ın ortaya koyduğu asit-baz dengesine alternatif bir fiziko-kimyasal yaklaşımı incelemekte.
Geleneksel yaklaşımın kısıtlı yönleri
Klasik yaklaşımda pH değeri H iyonlarına bağlıdır. Ama burada pH’a (hidrojen iyon konsantrasyonunun negatif logaritması) H+ değişikliği tamamen yansımamaktadır. H-H eşitliği CO2’in karbonik aside kimyasal hidrasyonunu tarif eder:
pH= pK + log[HCO3-] / çözünmüş CO2
Kan gazını değerlendirirken sadece [H+] ve PCO2’nin direkt ölçüldüğünü akılda tutmak gerekir; [HCO3-] ise H-H denkleminden hesaplanıp verilir. Bu denklemin neyi anlatıp neyi vermediğini düşünelim: Bu eşitlik artan ya da azalan aside bağlı problemlerin sınıflanmasına izin verir. PCO2 ve [HCO3-]’daki birbirleri ile iliskili olan degisimleri dikkatle incelendiginde, kronik ile akut respiratuvar sapmaları ve metabolik asidoz ile metabolik alkalozu ayıran bir karakteristik ayırt edilebilir.
Akut ve kronik asit-baz dengezi bozukluklarında PaCO2 ve [HCO3-]’daki değişiklikler:
Akut respiratuar asidoz HCO3- değişikliği = 0.2 x PaCO2 değişikliği
Kronik respiratuar asidoz HCO3- değişikliği = 0.5 x PaCO2 değişikliği
Akut respiratuar alkaloz HCO3- değişikliği = 0.2 x PaCO2 değişikliği
Kronik respiratuar alkaloz HCO3- değişikliği = 0.5 x PaCO2 değişikliği
Metabolik asidoz PaCO2 değişikliği = 1.3 x HCO3- değişikliği
Metabolik alkaloz PaCO2 değişikliği = 0.75 x HCO3- değişikliği
Buradaki kurallar göz önüne alınarak mikst bozukluklar saptanabilir. Ancak H-H eşitliği metabolik sapmanın şiddetini respiratuar komponentteki gibi gösterememektedir; ayrıca karbonik asit dışındaki asitler hakkında fikir vermemektedir.
Baz fazlası (Base excess, BE)
H-H eşitliğindeki metabolik komponenti ölçme eksikliğini gidermek için BE metodolojisi kullanılmıştır. Var olan hemoglobin (Hb) konsantrasyonunda ve PaCO2 5.33 kPa düzeyinde tutulduğunda, pH değerinin 7.40 olması için bir tam kan örneğine eklenmesi gereken asit veya baz miktarına BE denir.
Hb 15 g/dL olan oksijenlenmiş kanda, pH 7.4 ve PaCO2 5.33 kPa iken BE sıfırdır. Hb kandaki ana tampondur ve BE’i etkiler. Hb 5 g/dL (ekstrasellüler kompartımandaki ortalama Hb değerinin ampirik tahmini) değeri kullanıldığında in vitro ve in vivo BE değeri arasındaki farklılık azaltılabilir. Buna standart BE (SBE) denir; PCO2 değerinden bağımsızdır ve asit-baz bozukluğunun metabolik komponentini belirlemede kullanılabilir. Ancak BE, H-H eşitliği ile ilgili ikinci problemi, yani metabolik asit-baz bozukluğunun mekanizması hakkında fikir vermez.
Anyon açığı (anion gap, AG)
AG metabolik asit-baz bozukluğunun nedenini saptamamıza yardım etmek için ortaya konmuştur. Fizyolojik bir parametreden çok ölçümdeki bir artefakttır.
Elektriksel nötralite için katyon ve anyonlar dengeli olmalıdır:
ölçülmüş anyonlar + ölçülmemiş anyonlar = ölçülmüş katyonlar + ölçülmemiş katyonlar
Rutin ölçülen anyonlar Cl- ve HCO3-, katyonlar ise Na+ ve K+’dur. Serum proteinleri, fosfat, sulfat ve organik anyonlar (özellikle laktat ve keyoasitler) ölçülmeyen anyonlar, Ca++, Mg++, lityum ve immunglobulin G ise ölçülmeyen katyonları oluşturur.
AG esas olarak plasma proteinlerinin, ağırlıklı olarak albuminin negatif yüküne bağlıdır.
AG = (Na + K) – (Cl + HCO3)
Eskiden AG değerinin yukarıda verildiği haliyle 8-16 mmol/L arasında değiştiği kabul edilmekteydi. Yakın zamanda Cl’un daha kesin ölçülmesine bağlı olarak referans sınır 3-11 mmol/L düzeyine düşürülmüştür. Serum proteinlerinin AG değerine ciddi katkısı nedeniyle, hipoalbuminemide olduğundan daha düşük olarak saptanır. AG’nin doğruluğu, albumin için düzeltme yapılıp normal konsantrasyonun 40 g/L olduğu kabul edilerek sağlanabilir:
Albumini düzeltilmiş AG = AG + (0.25 x [40- ölçülen albumin g/L])
Bu formül AG’de ortalama 2.7 mmol/L kadar bir artış sağlar. Ortamda normal dışı olarak bulunan ölçülmemiş katyonların varlığında (örn. İmmünglobulin G ve hiperkalsemi) ve lityum verildikten sonra AG değeri düşebilir.
Alternatif yaklaşım
Bu kantitatif fiziko-kimyasal bakış açısını 1983’de Peter Stewart ortaya koymuştur. Günümüzde kritik hastaların asit-baz bozukluklarını açığa çıkartmak amacıyla ilgi görmektedir.
Temel prensipleri
Biyolojik sıvıların ortak 2 karakteristiği vardır: hepsi akuözdür (su içerikli veya suda çözünen) ve çoğu alkalidir (OH- iyonu H+ iyonundan fazladır).
Stewart’ın çalışması su bazlı solüsyonların bazı temel fiziko-kimyasal özelliklerine odaklanır:
1. Dissosiasyon: Solütün iyonik komponentinin ayrışması. Güçlü iyonlar solüsyonda tümüyle dissosiye olurlar, örneğin sodyumklorür solüsyonu. Diğer maddeler yalnızca kimsen ayrışırlar, örneğin solüsyondaki zayıf asitler hem anyonik dissosiye formda (A-) hem de ayrışmamış formda (HA) bulunurlar.
2. Elektronötralite: Akuöz bir solüsyonda herhangi bir kompartmandaki tüm pozitif yüklü iyonların toplamı negatif yüklü iyonların toplamına eşit olmalıdır. Saf su nötral bir solüsyondur, çünkü içerdiği H+ ve OH- konsantrasyonu eşittir. Bu iyonların konsantrasyonu temperatüre hassas bir dissosiasyon sabiti ile belirlenir.
3. Kütlenin korunması: Eklenmediği, çıkartılmadığı, üretilmediği veya ortadan kaldırılmadığı sürece bir maddenin miktarı sabittir.
Akuöz solüsyonlarda su dissosiasyon yolu ile bitmez bir H+ kaynağıdır; pH değişiklikleri H+’nun oluşum veya uzaklaştırılmasının sonucu değildir. Daha çok diğer bağımsız değişkenlere bağlıdır.
Stewart plazmada, vücut sıvılarının fiziko-kimyasal ortamına girince asit-baz durumunu belirleyen 3 adet matematiksel bağımsız bileşen tanımlamıştır. Bunlar:
1. Karbondioksit
2. Elektrolitler (güçlü iyonlar)
3. Zayıf asitler
CO2 parsiyel basıncı hücresel metabolizmanın CO2 üretimi (veya metabolik asitler tarafından HCO3’ün titrasyonu) ile alveoler ventilasyonla atılan CO2 arasındaki dengeye bağlıdır. Plazmada güçlü katyonlar (esas olarak Na+) güçlü anyonlardan (esas olarak Cl-) fazladır; ölçülen güçlü katyonların ve anyonların toplamı arasındaki fark güçlü iyon farkı (strong ion difference, SID) olarak adlandırılır.
SID = [Na + K + Ca + Mg] – [Cl + laktat]
Bikarbonatın güçlü bir iyon olmadığı dikkate alınmalıdır. SID’in su dissosiasyonuna, dolayısı ile H+ konsantrasyonuna güçlü bir elektrokimyasal etkisi vardır. Sağlıklı insanlarda SID 40-44 mmol/L’dir. Metabolik asidoz SID’de düşme ile oluşur. SID düştükçe (daha az pozitif olur) elektriksel nötraliteyi korumak için su daha fazla dissosiye olur. Serbest H+ iyonu arttığı için pH düşer. Buna karşılık metabolik alkaloz aşırı artmış SID’in sonucudur.
SID’i dengeleyen, yani elektriksel nötraliteyi koruyan negatif yükün kaynağı CO2 ve zayıf asitlerdir; çünkü:
SID – (CO2 + A-) = sıfır
Zayıf asitlerin çoğu protein (ağırlıklı olarak albumin) ve fosfatlardır. ATOT zayıf iyonların total konsantrasyonu (AH + A-) için kullanılan bir kavramdır. Hipoalbuminemi, plazmadan zayıf asitlerin kaybına eşdeğerdir ve hafif alkalinizan etkiye sahiptir; vücut buna SID’i azaltarak uyum sağlar.
Stewart’ın bağımsız değişkenlerinin asidik veya alkalinizan etkileri:
CO2 artışı asidite artar alkalinizan etki azalır
SID asidite azalır alkalinizan etki artar
Albumin asidite artar alkalinizan etki azalır
Fosfat asidite artar alkalinizan etki azalır
SID’i kontrol eden fizyolojik mekanizmalar
Güçlü katyon ve anyonların relatif konsantrasyonunu değiştiren primer organ böbrektir. Böreğin asiditeye müdahalesi klorid dengesi ile olur. Filtre edilen, absorbe edilmeyen her klorid iyonu SID’i arttırır. H+ ekskresyonu durumu etkilemez, zira su bu iyon için tükenmeyen bir kaynaktır. Ancak Cl- ile birlikte ekskrete edildiğinden amonyum (NH4-) sistemik asit-baz dengesi için önemlidir. Amonyum ve glutaminin hepatik üretimi asit-baz dengesini etkiler ve plazma pH’ına duyarlı mekanizmalarca yakından kontrol edilir; hepatik glutaminogenez asidozda stimüle olur. Glutamin böbrekte amonyum yapımı için kullanılır ve böylece klorid ekskrete edilir, dolayısı ile plazmayı alkalinize eden bir etki gösterir.
Gastrointestinal sistemin de SID’e önemli etkisi vardır. Midede plazmadan lümene pompalanır ve SID yükselir; yemeğin başlangıcında gastrik sekresyon yapımı tepe noktada iken alkalinizan etki görülür. Kusma veya aspire edilmek suretiyle gastrik sekresyonun kaybı (Cl- kaybı) metabolik alkaloza yol açar. Pankreas ise SID değeri yüksek, kloridi düşük sıvı salgılar. Büyük miktarda pankreatik sıvı kaybında (cerrahi drenaj) plazma SID’i düşeceğinden asidoz gelişir. İnce barsaklar kloridin çoğunu absorbe ettiğinden kalın barsaklarda SID yüksektir. Ciddi diyarede büyük miktarda katyon kaybedildiğinden plazma SID’i düşer ve asidoz olur.
Stewart eşitlikleri
Asit-baz dengesine yaklaşımını 6 adet bağımsız eşzamanlı denklem ile ortaya koymaktadır:
[H+] x [OH-] = K’w
[H+] x [A-] = Ka x HA
[HA] + [A-] = A TOT
[H+] x [HCO3-] = Kc X PCO2
[H+] x [CO23-] = Kd x [HCO3-]
SID + [H+] – [HCO3-] – [CO23-] – [A-] – [OH-] = sıfır
Bunlar 3 temel prensibin 3 bağımsız değişken ile birleştirilmesidir. Bu eşitlikler tekrar modifiye edilerek Fencl-Stewart yaklaşımı olarak bilinen 5 eşitlik daha ortaya konmuştur. Sodyum ve kloridin ekstrasellüler SID’in temel bileşenleri ve albuminin ana ekstrasellüler zayıf asit olduğunu dikkate alarak Story ve ark. anormal SBE’in nedenlerini klinikte tanımaya yönelik daha basit bir yaklaşım ortaya koymuşlardır:
1. Kan gazındaki SBE
2. BE üzerine sodyum-klorid etkisi = Na – Cl -38
3. Albuminin etkisi = 0.25 x (42-albumin)
4. Ölçülmemiş iyonların etkisi = SBE – (Na-Cl etkisi) – (albumin etkisi)
Bu yaklaşımla örneğin peroperatif %0.9 NaCl 5-6 L verildikten sonra hastanin asidoza kayacağı kolayca ortaya konulmaktadır.
Sıvılara farklı gözle bakmak
İntravenöz sıvılar ekstrasellüler sıvılar ile bir dengeye gelmekte ve ekstrasellüler alanın SID ve ATOT değerini değiştirmektedir. Verilen sıvının CO2TOT’u bunu etkilememektedir. Başka bir deyişle sodyum bikarbonat preparatlarında metabolik asidozu çözen faktör HCO3- bulunması değil, solüsyondaki yüksek SID (%8.4 NaHCO3 için 100 mmol/L) değeri ve ATOT’un bulunmamasıdır.
Hangi sıvı ?
Yüksek miktarda serum fizyolojik kullanımı metabolik asidoz ile sonuçlanır. Bu en iyi hipovolemik hastaların resüsitasyonunda dökümante edilmişse de, normovolemik hemodilüsyon ve kardiyopulmoner bypassın da benzeri etki potansiyeli vardır. Mekanizma bikarbonatın dilüsyonu değildir (çünkü bağımlı değişkendir ve kaybı asidoza yol açamaz). Verilen kloridin SID’i düşürmesi (bağımsız değişken) suyun dissosiasyonunu ve buna bağlı H+ mikatarını arttırdığından hiperkloremik metabolik asidoz gelişir. Serum fizyolojikte (%0.9 NaCl) Na ve Cl miktarı eşittir (154 mmol/L), SID sıfırdır. Büyük miktarda infüze edildiğinde total vücut kloridine (normalde ~ 100 mmol/L) etkisi Na’a (normalde ~ 135 mmol/L) oranla daha fazla olmaktadır. Bu etki hipotonik sıvıların (%5 dekstroz, dekstroz-salin) verilmesi ile görülen dilüsyonel asidoz ile karıştırılmamalıdır. Bu durumda hiponatremi sonucu SID düşecektir. Özellikle kritik hastalar stres cevaba bağlı artmış ADH nedeniyle bu tür değişikliklere karşı hassastır.
Hartman solüsyonu (ringer laktat) dengeli bir elektrolit solüsyonudur. SID’i (27) plazmadan düşük olmakla birlikte sıfır değildir. Albuminsiz sıvı transfüzyonuna bağlı ATOT dilüsyonel alkalozuna karşı koyacak kadar plazma SID’ini düşürür. Ağır karaciğer yetersizliği olmadığı sürece içerdiği 29 mmol/L laktat hızla metabolize edilir.
Su kaybına bağlı hipovolemide iyonların total konsantrasyonu değişmese de, sodyum yükselmesi kloridden fazla olacağı için SID artar. Kontraksiyon alkalozunun mekanizması budur. Bu hastalar serum fizyolojik veya bir başka sıvı verildiğinde sıfır SID ile cevap verirler. Bazı metabolik alkaloz tipleri hipokalemi ve total potasyum defisiti ile birliktedir. Bu durumda potasyumklorid verilmesi alkalozu düzeltebilir. Zira potasyum hücreye girer, güçlü anyon olan klorid ise ekstrasellüler alanda kalıp plazma SID’ini azaltır.
Kritik hastalarda sıvı resüsitasyonunda kolloidler sık kullanılır. Çok merkezli, randomize bir seride yoğun bakımda resüsite edilmiş hastalarda % 0.9 NaCl ile %4 albumin kullanımı kıyaslanmış (SAFE çalışması) ve 28 günlük sonuçlar açısından fark gösterilememiştir. Kullanımdaki kolloidlerin hepsi SID’i düşürerek (solüsyonlardaki SID değerleri %4 albuminde 12, haemaccel için 17, gelofusine için 34, pentastarc için ise sıfır) metabolik asidoza yol açma eğilimindedir. Ancak genellikle sıvı resüsitasyonunda daha az volüm gerektirdiklerinden bu etki hafiflemektedir.
Kan alınırken sitrat iyonları ve az miktarda fosfat içeren bir koruyucu (genellikle CPD-A) ile karıştırılır. İçerdiği Na katyonu 1 ünite kanın efektif SID değerine 40 mmol/L ekler. Büyük miktar kan transfüzyonu sonrasında sitrat metabolize olduktan sonra metabolik alkaloz görülmesinin nedeni budur. Ağır karaciğer yetersizliğinde ise sitrat birikeceğinden metabolik asidoz ve hipokalsemi ortaya çıkacaktır.
Güçlü iyon açığı (strong ion gap, SIG)
SIG laktat dışındaki ölçülmemiş anyon miktarını ifade eden bir kavramdır. Miktarı görünen SID (apparent SID, SIDa) ile efektif SID (SIDe) arasındaki fark ile belirlenebilir.
SIDa = (Na + K + Ca + Mg) – (Cl – laktat)
SIDe= CO2 + A- [çünkü elektronötralite için SID – (CO2 + A-) = sıfır olmalıdır]
SIG = [SID] – [HCO3-] – [albumin-]
SIG normalde sıfırdır, yani karbondioksit ve zayıf asitlerin net negatif yükünü SID’in net pozitif yükü dengelemektedir.
SIG, AG ile aynı şey değildir. AG’nin tahmini değeri SIG + A- toplamı kadardır. Artmış SIG ile beraber metabolik asidoz diyabetik ketoasidozda oluşabilir; SIG plazma keton konsantrasyonu miktarını yansıtır. Metabolik asidozlu kritik hastalarda SIG’in natürü bilinmemektedir. Resüsitasyon öncesi SIG değeri travma hastalarında kan laktatı, pH veya travma ağırlık skorlarından daha iyi mortalite öngörüsü sağlamaktadır.
Klorid sodyum oranı
Cl: Na oranı (normali 0.75-0.79) asit baz bozukluklarında hiperkloreminin rolünü değerlendirmede basit bir kantitedir. Oran yüksekse asiditeyi arttıran etki görülür. Metabolik asidozu olan hastada oran yüksekse, asidozun nedeni hiperkloremidir. Oran normal ve metabolik asidoz varsa mikst asidoz söz konusudur, yani hiperkloremi ve artmış SIG vardır. Oran düşük ve metabolik asidoz varsa SIG artmış demektir. SID’deki iyonlar negatif yüklü olduğundan, katyonlar (K ve Na) sabit kalırsa diğer plazma iyonları (örn. Klorid albumin) elektronötraliteyi korumak için düşmelidir. Klinik olarak doku asitlerinin varlığında hem Cl:Na oranı hem de serum albumini düşecektir.
Metabolik alkalozda Cl:Na oranı genellikle düşüktür. Bu bikarbonat konsantrasyonundaki artıştan çok kloriddeki düşüşe bağlıdır. Örneğin furosemid böbrekten Na’dan çok Cl kaybettirir, sonuçta oran düşer, SID artar ve metabolik alkaloz olur.
Laktik asidoz ve hiperlaktatemi
Hipovolemik şok ve hipoperfüzyon kritik hastalarda laktik asidoza neden olabilir. Hipoperfüzyona bağlı laktat oluşumu SID’i düşürür ve proton yapımını arttırır. Bu ringer laktat solüsyonundaki laktattan farklıdır. RL verilince laktat metabolize olur ve geride Na kalıp SID’i arttırır. Laktik asidoz uzun yıllar survi öngörüsünde kullanılmıştır. Günümüzde gereksiz tedaviyi önlemek için laktik asideminin hiperlaktatemiden (normal pH ve yüksek laktat konsantrasyonu) ayrılması önemlidir. Hiperlaktatemi, ara metabolizmanın arttığı kritik hastalarda ya da renal replasman tedavisi sırasında verilmesi nedeniyle sık görülür ve mutlaka kötü sonuçlara götürecek diye bir kural yoktur.