İki yazıda kontrollü hipotansiyona değinmeye karar verdik. Temel kaynak Degoute ve ark. tarafından yayınlanan derleme…
Tanım: Kontrollü hipotansiyon (KH) cerrahi girişim sırasında arteriyel basıncı düşürerek kan kaybını ve transfüzyon ihtiyacını azaltmayı hedefleyen bir tekniktir. İlk kez 1917’de Cushing tarafından ortaya konulmuştur.
Kansız cerrahi sahanın sağlanması ortakulak ameliyatlarında, endoskopik sinüs mikrocerrahisinde, plastik ve rekonstrüktif mikrocerrahide, oftalmolojik cerrahi ve beyin cerrahisinde çok büyük bir öneme sahiptir. KH ayrıca transfüzyon gereksinimini azaltabilmek için, ortopedik, ürolojik, kardiovasküler cerrahi ve karaciğer transplantasyonu gibi ortalama ya da aşırı kanama potansiyeline sahip birçok cerrahi türde de kullanılmaktadır.
KH sırasında vital organlar hipoperfüzyona maruz kalmamalı, organ perfüzyonu ile doku oksijenasyou aynı seviyede tutulmalıdır. Bu yüzden KH genel olarak:
Fizyolojik Mekanizmalar: Kanamanın azaltılması için ortalama seviyedeki KH’un sağlanması uğraşı gerektirir. Kanamanın birim zaman içinde ameliyatla ilgili bir alanda ortaya çıkan kan miktarı olarak tanımlanır.
Matematiksel olarak bahsedilen akım D (hacim/zaman) D=P/R olarak tanımlanabilir. Buradaki P= basınç ve R= vasküler rezistansı simgelemektedir.
Eğer basınç(P) azalırsa, ya da vasküler rezistans (R) değişmeden kalır veya artarsa (vazokonstriksiyon) akım D düşer. Diğer taraftan, basınç (P) düşerken R (vazodilatasyon) de birlikte azalırsa, akım D değişmeden kalır ya da biraz değişir. İşte bu yüzden, kanama yönünden KH’nun sonucu, vasküler rezistans R’ye bağlıdır.
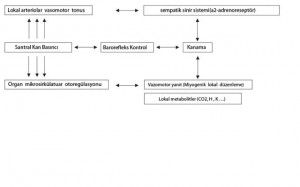
Kanayan miktar D’yi KH ile kontrol altına almaya çalışmadaki zorluk, amaçlanan basıncın geniş damarlar seviyesinde ölçülmesinden kaynaklanır; ancak bu doku sirkülasyonu seviyesinde kanamanın gerçekleştiği ameliyat bölgesindeki basınçtan çok farklıdır. Bu iki basınç arasındaki farklılık ise SKB regülasyonu ile periferik vasküler rezistans regülasyon mekanizmalarının karmaşıklığından ve anlaşılmazlığından kaynaklanır. Ayrıca vazomotor tonus regülasyonu bir bölgeden diğerine homojen özellik göstermez. Cerrahi seviyedeki P ve R lokal değerlerdir. Lokal vasküler rezistans ilk olarak santral kan basıncının büyük damar regülasyon sistemine, ikinci olarak sempatik sinir sistemine ve üçüncü olaraksa, (eğer varsa) organın mikrosirkülatuar otoregülasyonuna bağlı [Bkz. Resim 1].
Bazı KH tekniklerinde, kardiyak debideki düşüş kan kaybının azalmasındaki en belirleyici özelliktir; diğer tekniklerde ise, kan kaybını belirleyen OAB’ındaki düşüştür. Ameliyattaki kanamanın azalmasından sorumlu olan mekanizmalar:
Kullanım Amaçları: KH kansız operasyon sahası sağlamak, kan ve kan ürünü kullanımını azaltmak için uygulanır.
Operasyon sahasında kanamanın azaltılıp cerrahi görüşün iyileştirilmesi için uygulanan KH ile ilgili az sayıda çalışma var: OAB’nın 90 mm Hg’dan 50-65 mm Hg’ya düşmesi, ya da SKB’nın 125 mm Hg’dan 70-90 mm Hg’ya düşmesi, endoskopik sinüs cerrahisi, mandibular osteotomi ve timpanoplasti vakalarında iyi bir ameliyat sahası sağlamıştır.
Kan kaybını azaltmak için KH uygulaması geçtiğimiz yarım yüzyılda çok tartışıldı. İlk KH çalışması Eckenhoff ve Rich tarafından 1966’da yayımlanmıştır. Bu çalışma OAB 60-65 mm Hg’ye düştüğünde kan kaybının kontrole oranla %50’ye varan oranda azaldığını göstermiştir. Daha sonraki çalışmalar, yeni ajanlarla bir kontrol serisiyle ya da daha eski ajanlarla karşılaştırarak, basıncın bu seviyelerinin etkinliğini göstermeye devam etti. Mandibular osteotomide, pediyatrik spinal cerrahide, turnikeli diz prostetik cerrahisinde, kalça ameliyatında, radikal prostatektomide kan kaybının KH ile azaldığı, total kalça protezi ameliyatında transfüzyon gereksiniminin düştüğü bildirilmiştir.
Limitler ve Komplikasyonlar: Kan basıncındaki herhangi bir düşüş distal organ perfüzyonu ve doku oksijentasyonu hakkında endişelere sebep olmaktadır. Doku hipoksi riskinin değerlendirilmesi zordur. Buna rağmen uzun bir süre boyunca ciddi KH’da (OAB<50 mm Hg) kalmış büyük bir hasta serisinin birçoğunda hiçbir spesifik komplikasyona rastlanmamıştır. KH vital organların mikrosirkülatuar otoregülasyonunu baskılayarak ya da azaltarak doku hipoksisine yol açabilir ve bunu otonomik sinir sistemini inhibe ederek yapabilir.
KH’nun şu an günümüzdeki amacı, kanamada bir azalma yaratabilmek adına yeteri kadar düşük kan basıncına ulaşmaktır. Ancak bunu yaparken vital organların (beyin, kalp, böbrek) mikrosirkülasyon otoregülasyonu riske atılmamalıdır.
Morbidite eski çalışmalarda KH’un serebral, koroner, renal, splanknik ve hepatik mikrosirkülatuar dezavantajlarına odaklanmamıştır. Anestezide KH uygulamasının mortalitesi 1961’de % 0.055 olarak kayıtlara geçmiştir. Bu oran o dönemdeki tüm anestezi türlerindeki mortalite oranından (% 0.01-0.007) çok da farklı değildi. Daha sık rastlanan (% 3.3) non-fatal komplikasyonlar 1953’te tanımlanmıştır. Morbidite major nörolojik komplikasyonlardan (baş dönmesi, serebral, retinal ve serebellar tromboz) kaynaklanmaktadır ki çok düşük ve değişken bir oluş sıklığına sahiptir. Bir başka potansiyel komplikasyon ise anüriydi. Şu an elimizde bulunan bilgilerin hiçbiri, OAB 50-65 mm Hg arasındaki bir KH’un, genç ve sağlıklı hastalarda bir risk oluşturacağına işaret etmiyor. Bununla birlikte KH için aday olanların çoğunun, basit bir klinik muayene ile kolayca teşhis edilemeyecek organ disfonksiyonu olabileceği dikkate alınmalıdır.
En son literatür KH kontrendikasyonları hakkında herhangi bir bilgi sağlamamaktadır. Geniş cerrahi girişimlerde ve dini nedenlere bağlı kan naklinin uygulanamadığı durumlarda başvurulmaktadır. Doku perfüzyonu hastanın durumuna ve gereksinimlerine bağlı olduğundan katı kontrendikasyon sınırları vermek doğru olmayacaktır. Serebral veya renal vasküler hastalıklar, alt ekstermite vasküler hastalığı ya da hepatik, renal veya koroner disfonksiyon, hipovolemi ya da anemi KH uygulamasından olumsuz etkilenebilir. Tedavi altında hipertansiyonu olan hastalar herhangi bir risk grubu altında gibi gözükmemektedirler. Ancak hastanın hipertansiyon tedavisi için kullandığı ilaçlar, hipotansif ilaçlar veya anestezik ajanlarl çakışabilir, regülatuar mekanizmaları bozabilir ve hastayı vazodilatatör ya da antiadrenerjik ajanlara daha duyarlı hale getirebilir.
Kan Kaybını Azaltan Diğer Teknikler: Düşük kanama potansiyeli olan ama başarılı geçmesi için daha kansız bir operasyon sahası gerektiren cerrahiler (sinüs cerrahisi, ortakulak cerrahisi, mikro cerrahi, oftalmik veya beyin cerrahisi) kar/zarar oranı analizinden sonra KH’un yeni tekniklerinden faydalanabilir.
Orta veya yüksek kanama potansiyeli olan bir ameliyatın (ortopedik, ürolojik, kardiyovasküler ve solid organ transplantasyonu) allojenik transfüzyon oranını, infeksiyöz ve noninfeksiyöz komplikasyon riskini azaltmak için diğer kan koruyucu tekniklerinden fayda sağlamak mümkündür [Bkz. Tablo 1]. Allojenik transfüzyona, otolog kan transfüzyonu, normovolemik hemodilüsyon, intraoperatif kan kurtarımını içeren alternatifler geliştirilmiştir [Bkz. Tablo 2].
Otolog transfüzyon, homolog transfüzyon ile eşlik eden risklerin olasılığını azaltmıştır ama post-transfüzyonel immunosüpresyon üzerindeki etkileri hala tartışılmaktadır. Dahası bakteriyel enfeksiyon riskleri, aşırı volemi homolog transfüzyonla aynıdır. Otolog transfüzyonun maliyeti, kullanılmayan üniteler herhangi biryerde kullanılmaz ve yok edilmelidir sözü dikkate alındığında oldukça yüksektir. Preoparatif normovolemik hemodilüsyonun (kanı ameliyattan hemen önce almak ve hemen sonrasında vermek) etkililiği nonkardiyak cerrahide ispatlanmıştır.
Hepatik cerrahi sırasında yapılan bir araştırmada hemodilüsyonla % 24’lük hedef hematokrit karaciğerde, böbrekte veya koagülasyon testlerinde herhangi bir anormalliğe neden olmamıştır. Kontrole göre hemodilüsyon yapılan hastalardan daha azı allojenik kan kullanmıştır.
Aspire edilen kanın yıkanıp yeniden kullanımı vasküler ve ortopedik operasyonlarda faydalıdır. Ama bunun onkolojik cerrahide kullanımı metastatik potansiyelli hücrelerin yayılım riski yüzünden tartışılmaktadır. Sadece bir çalışmada filtre ve irradyasyon sonrasında bu tür kan kullanılmıştır. Aseptik ama uzun ve hemorajik müdahelelerde yıkanmış kan mikroorganizma ve toksinleri ile enfeksiyon riski taşır. Ayrıca heparin varlığında kan kaybında artış olabileceği dikkate alınmalıdır. DİK, ARDS gelişimi bildirilmiş vakalar olduğu ve sistemdeki koruma mekanizmasına rağmen hava embolizmi riski de unutulmamalıdır.
Hemostaz, koagülasyon veya fibrinoliz sürecine etkili olan farmakolojik ajanlar KH’a birer alternatiftir. Desmopressin’in primer hemostasis üzerinde olumlu bir etkisi vardır. İntraoperatif kanamayı azaltmada birbiri ile çatışan sonuçlarla ortopedik cerrahide proflaktik olarak kullanılmıştır. Desmopressinle ilgili en son çalışmalar kanamada ya da transfüzyon ihtiyacında herhangi bir azalma bulmamıştır. Kallikrein’in antifibrinolitik inhibitörü olan Aprotinin’in hemostatik etkisinin kardiyak, hepatik ve ortopedik cerrahide transfüzyon gereksinimini azalttığı rapor edilmiştir. Prostetik kalça cerrahisinde yüksek doz Aprotinin’in perioperatif eritrosit gereksinimini %50’ye kadar azalttığı ama allojenik kanla transfüze edilen hastaların oranını azalmadığı bildirilmiştir. Benzer bir şekilde az bir transfüzyonel getiri de (ortalama 1 Ü) prostetik diz cerrahisinde görülmüştür. Bu allojenik proteine karşı sık ve aşırı allerjik reaksiyon ve fatal anafilaksi riski de dikkate alınmalıdır. Son altı ayda Aprotinin kullanan kardiyak cerrahi hastalarının %20-50’sinde IgG tipinde antiaprotinin antikoru bulunmuştur. Ortopedik ve daha önemlisi hepatik cerrahide ortaya çıkan tromboz risk aprotini kullanımının artması ile değişmemiştir; ama bu şekilde zararsız olduğu şüphelidir ve hepatik, ortopedik cerrahide rutin kullanılması tavsiye edilmemektedir.
Uzun geçmişine rağmen, sentetik antifibrinolitiklerin, kanamayı azaltma konusundaki çalışmalar daha yeni ve tamamlanmamıştır. Traneksamik asitin, özellikle kardiyak müdahalelerde, karaciğer nakli ameliyatlarında ve turnike ile yapılan ortopedik cerrahide kanamayı azalttığı görülmüştür; ancak transfüzyonel etkilerinde istenilen sonuç alınamamıştır.
Resim 1. İntraoperatif kanamayı azaltmada sorumlu kan basıncı ve vasomotor tonus regülasyonunun mekanizması. ↔ iki yönlü etki; ↑↑↑ ve ↓↓↓ etkinin öncelikli yönü
Tablo 1. Allojenik Transfüzyon Komplikasyonları
|
Risk |
Ünite Başına Olasılık |
|
Enfeksiyon |
|
|
HIV |
1/67 6000 |
|
Diğer |
|
|
Benign |
|
|
Ateş olmadan titreme |
1/100 |
|
Ürtiker |
1-3/100 |
|
Ciddi |
|
|
ABO uyuşmazlığı |
1/25 000 |
|
Anaflaktik Şok |
1/20 000 |
|
ARDS |
1/100 |
|
Graft Hastalığı |
1/100 |
|
Purpura |
1/100 |
|
Aşırı yüklenme |
1/100 |
Tablo2. Cerrahide Kan Transfüzyonlarına Alternatifler ve Eşlik Eden Komplikasyonlar
|
Tür |
Komplikasyon |
|
Otolog transfüzyon |
Enfeksiyon, aşırı yükleme, hata |
|
Akut normovolemik hemodilüsyon |
Kalp yetmezliği |
|
İntraoperatif kan kurtarımı |
Enfeksiyon, DİK, ARDS, gaz embolisi |
|
Farmalojik ajanlar Desmopressin |
Trombotik potansiyel |
|
Traneksamik asit |
Trombotik potansiyel |
|
Aprotinin |
Allerji, tromboz |