 Böbrek, plazma volümü ve eritrosit kütlesini kontrol ederek ve bu iki komponente dayanarak hematokriti (Hct) belirlemekte. Böbrek içi doku oksijen sinyaline göre böbrek indirekt olarak kan volumunu algılıyor ve eritropoietin (EP) üretiyor. EP üretimi anjiotensinII (anjII) tarafından module ediliyor, dolayısı ile renin-anjiotensin sistemi EP üretimine kan volüm regülasyonu feedback’inin efektor sinyali olarak katılmış oluyor. Yani böbrek yalnızca EP üreticisi değil aynı zamanda Hct belirleyicisi oluyor ki bu da bizim kan volümü regülasyonu hakkındaki bilgilerimize yeni bir boyut eklemekte.
Böbrek, plazma volümü ve eritrosit kütlesini kontrol ederek ve bu iki komponente dayanarak hematokriti (Hct) belirlemekte. Böbrek içi doku oksijen sinyaline göre böbrek indirekt olarak kan volumunu algılıyor ve eritropoietin (EP) üretiyor. EP üretimi anjiotensinII (anjII) tarafından module ediliyor, dolayısı ile renin-anjiotensin sistemi EP üretimine kan volüm regülasyonu feedback’inin efektor sinyali olarak katılmış oluyor. Yani böbrek yalnızca EP üreticisi değil aynı zamanda Hct belirleyicisi oluyor ki bu da bizim kan volümü regülasyonu hakkındaki bilgilerimize yeni bir boyut eklemekte.Bobregin kan volumu ayarlamasinda oynadigi lider rolu inceleyen bir yazi Am J Med Sci 2007;334(1):65’de ‘The Role of the Kidney in Blood Volume Regulation: The Kidney as a Regulator of the Hematocrit’ basligi ile yayinlandi.
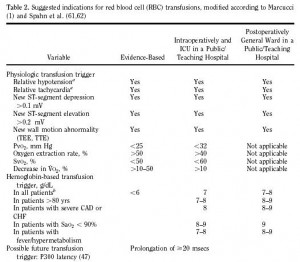
Dolasimdaki kan miktari, kardiyovaskuler sistemin etkinligini maksimumda tutacak sekilde ayarlanir. Hct ise, oksijen sunumunu kardiyovaskuler is veya kan akimi ile maksimumda tutacak sekilde ayarlanır. Bu iki parametre birbiri ile bagintili olsa da regulasyonlari farkli mekanizmalar ile olur.
Kan volumu ve Hct regulasyonunda 4 anahtar nokta rol oynar:
Kan volumunun plasma komponenti bir feedback sistemi ile ayarlanir: Vasküler dolgunluk ve kan basincini algilayan aferent sinyaller merkezi sinir sisteminde (MSS) islenir; olusan efferent sinyaller renal Na ve su atilimini duzenler.
Yeterli doku oksijenasyonunu garantileyen eritrosit kutlesinin regulasyonu gene bir feedback sistemi ile saglanir. Burada bobregin rolu EP uretimidir.
Bobregin ‘critmeter’ fonksiyonu plazma volumu ve eritrosit kutlesinin, Hct regulasyonu surecindeki koordinasyonunu ayrintilandirmaktadir.
AnjII’nin EP uretimine etkisi, kan volumu ve Hct regulasyonu eslesmesi ile tanimlanmistir.
I. Plasma Volumu Regulasyonu
Ekstraselluler sivi (ESS) volumu, afferent sensorler (volum ve basinc) ve efferent efektor mekanizmalardan olusan bir feedback halkasi sayesinde dar sinirlar icinde idame ettirilir. Sinyaller MSS’de islenerek efektor organlara Na ve su atilimi yoluyla vaskuler kapasitansin dengesini saglayacak optimal kan volumunu duzenleyecek efferent sinyaller gonderilir. Bu modelde kanin yalnizca plazma komponenti ile ilgili duzenleme soz konusudur.
Afferent yolda lokal, bolgeye ozel dusuk basinc (volum degisikligini algilar) ve yuksek basinc sensorleri vardir. Dusuk basinc sensorleri kardiyopulmoner (atriyal, ventrikuler ve pulmoner), renal ve hepatik reseptorleri icerir. Atriyal gerilim reseptorleri plasma volum artisina bagli atriyal duvar gerilimini algilar ve vagal afferent sinyalleri uyarir. Boylece ADH sekresyonu azalir, su emilimi azalarak su diurezi olusur. Atriyal gerilim reseptorleri ayrica kardiyomiyositik atriyal natriuretik peptit (ANP) sekresyonunu stimule eder; buna bagli renal Na atilimi artar, renin uretimi ve aldosteron sekresyonu azalip distal Na emilimi duser. Bu multipl effektor mekanizmalar ile plazma volum dengesi duzeltilir. Ventrikuler basinc reseptorleri ventrikuler basinc dususunu algilar ve vagal afferentleri stimule ederek renin sekresyonunun sempatik stimulasyonunu inhibe eder. Kucuk hava yollarinin bronsial venulleri (pulmoner sensorler) sol atriyal basinctaki hafif artisa ve pulmoner lenfatik obstruksiyona cok hassastir. Stimule olduklarinda refleks su diurezi ortaya cikar.
Bobrek afferent arteriollerindeki basinc reseptorleri basinc degisikliklerine hassastir. Miyojenik refleksin parcasi olarak afferent arterioldeki basinc artisi burada refleks vazokonstriksiyona, tam tersi ise vazodilatasyona yol acar. Jukstaglomeruler kompleks distal Na gecisine hassastir. Na miktari azalinca renin, anjII, aldosteron sekresyonu artar ve olusan efferent vazokonstriksiyon ile GFR ve distal Na reabsorbsiyonu artar (tubuloglomeruler feedback). Miyojenik refleks ve tubuloglomeruler feedback renal kan akiminin otoregulasyonunu saglar.
Hepatik dusuk basinc baroreseptorleri hepatik venoz sistemdeki basinc degisikliklerini algilar. Hepatik venoz konjesyon vb. nedenlerle basinc artarsa MSS’e sempatik afferent sinyaller gonderilir ve renal+kardiyopulmoner efferent aktivite artar. Sonucta renin-anjiotensin-aldosteron yukselir, tubuler Na ve su reabsorbsiyonu artisi ve kardiyak debide artis saglanir.
Arkus aorta ve sinus karotikustaki arteryel baroreseptorler de afferent sensorlerdir. Ortalama arter basinci (MAP) ve nabiz basinci degisikliklerini algilarlar. Ani MAP dususu normalde olan afferent vagal ve glossofaringeal afferent tetiklemeyi azaltir; medullaya giden inhibitor sinyaller azalinca, kalp ve bobrege giden efferent sempatik sinyallerin inhibisyonu ortadan kalkar. Sonucta perfuzyon basinci artar ve sivi dengesi duzeltilir.
II. Eritrosit kutlesinin regulasyonu
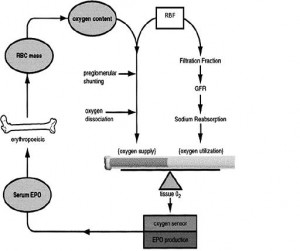
Dokuya oksijen sunumunu belirleyenler kan oksijen icerigi (oksijen saturasyonu ve Hb konsantrasyonu), kan akimi (kardiyak debi lokal vaskuler kan akimi) ve oksijenin Hb’den dissosiasyonudur (doku duzeyinde Hb’in O2’e afinitesi). Yeterli sunum, kan akimi veya oksijen icerigindeki (content) degisikliklerle saglanir. Akim degisikligi ise tum dokularda kardiyak debi veya rejyonel kan dagilimi ile ayarlanabilir. Eritrosit kutlesi renal EP uretimine baglidir. Doku hipoksisine cevap olarak korteksteki peritubuler fibroblastlar EP uretir; EP ile kemik iliginde eritrosit uretimi stimule olur. EP uretimi, oksijen sunumu ve renal dokunun oksijen gereksinimi tarafindan yonetilen bir feedback halkasi ile calisir. Hct dusunce plasma EP duzeyi ters logaritmik olarak artar.
Dokunun metabolik gereksinimi, dokuya gelen kan akiminin belirleyicisidir. Ama renal dokuda bu kuralin aksine kan akimi, GFR ve renal Na reabsorbsiyonuna olan etkileri nedeniyle indirekt olarak renal metabolik gereksinimi belirler. Ayrica renal kan akiminin otoregulasyonu nedeniyle, dıger dokulardan farkli olarak oksijen sunumunu duzenlemek icin olusacak kan akimi degisiklikleri de bobrekte kisitlidir. Bu nedenle bobrege oksijen sunumunda anahtar rolu ustlenen oksijen icerigidir. EP uretimi bobregin dusuk oksijen tansiyonuna (oksijen sunumu ile tuketimi arasindaki net fark) karsi effektor cevabidir; boylece eritrosit kutlesinin belirleyici olarak bobrek anahtar rol ustlenmektedir.
Hct duzeyi ile oksijen sunumu iliskisi, dusuk Hct degerlerinde direkt iken, cok yuksek Hct degerlerinde viskozitenin kan akimina etkisi nedeniyle tersine doner.
Oksijen sunumunu maksimal arttiran Hct degerine denk dusen infleksiyon noktasi optimal Hct degerini verecektir. Boyle bir deger Hct’nin iyi regule edilen bir parametre oldugunu dusundurmektedir. Hct 2 kan komponentinin, yani plasma volumu ile eritrosit kutlesinin bileskesidir. Dolayisi ile regulasyon icin bunlarin algilanmasi ve bir effektor sinyal ile bu iki komponentin optimal Hct icin ayarlanmasi gereklidir. Bobrekte bu iki komponentteki degisikligin afferent sinyali ortak faktor olan doku oksijen tansiyonudur. Bazal oksijen gereksiniminin yani sira, renal plazma akimi (RPF), Na reabsorbsiyonu ve O2 tuketimi arasinda direkt lineer bir iliski vardir. Renal kan akimi (RBF) glomeruler filtrasyona yonlenir ve filtre edilen Na’un %99’u ATP kullanilarak reabsorbe olur. Dolayisi ile RPF bobrek oksijen kullaniminin belirleyicisidir. Bunun da otesinde filtrasyon fraksiyonu (GFR/RPF) oksijen gereksinimi/oksijen sunumu oranini belirlediginden, GFR oksijen gereksinimini belirleyecek ve RBF oksijen sunumunu etkileyecektir. EP uretimini belirleyen oksijen sunum-tuketim feedback halkasidir. Bobrekte sunum tuketim iliksisinin kan akimi ile ayarlanmasi, hem eritrosit miktarinin hem de plasma volumunun doku oksijen basincina bagli olmasi bu iki volumun koordinasyonunu mumkun kilmaktadir.
‘Critmeter’ hipotezi bobregin, doku oksijen basincinin metabolik sinyali araciligi ile relatif plazma ve eritrosit kutlesini algilamasi ve cevap vermesi olarak tanimlanmaktadir. EP uretimi bobrekte bilinmeyen bir oksijen sensorunun varligini gerektirse de, critmeter konsepti bu tur bir sensorun varligini one cikartmaktadir.
Bobrek kardiyak debinin %20’sini alir. Gelen O2’in %8-10’unu kullanir. Ancak ani bir akim artisi olursa vaskuler anatominin heterojen olmasi ve tubuler fonksiyon nedeniyle oksijen basinci korteksteki EP uretilen jukstaglomeruler bolgede daha dusuk hale gelir. Critmeter’in bu fizyolojik EP uretim bogeleri olan kortikal piramitlerin tepesinde oldugu dusunulmektedir. Anemi derinlestikce EP tum kortekste uretilebildigine gore, critmeter fonksiyonunun ancak fizyolojik sartlardaki uretim bolgeleriyle sinirli oldugu ongorulmektedir.
EP uretiminin modulasyonunda renin-anjiotensin sisteminin (RAS) rolu:
RAS plasma volumunun belirlenmesinde anahtar rolu ustlenir. Ayrica EP uretimini etkiler. AnjII vaskuler, glomeruler ve tubuler etkilidir ve bu yolla doku oksijen basincini degistirebilir. Afferent arteriolde olusturdugu vazokonstriksiyon ile filtrasyon fraksiyonunu arttirir. Dolayisi ile artan Na reabsorbsiyonu yolu ile O2 tuketimini arttirir. Ayrica vasa recta’da konstriksiyon yaparak meduller ve jukstaglomeruller kan akimini, dolayisi ile O2 sunumunu azaltir. Sonucta doku oksijen basinci duser. Critmeter bolgelerindeki esik deger asilarak EP uretimi gerceklesir. Normal insanlarda anjII’nin Hb duzeyinde degisiklik olmadan EP duzeyini arttirdigi gosterilmistir (Lo V, Lenga I, Donnelly S. J Am Soc Nephrol 2007; In Press.) Losartan ile etkisi bloke edildiginde ise anjII infuzyonunun EP degerini degistirmedigi gozlenmistir. Plasmaferez yapilan olgularda plazma volumunde %2 azalma, Hct’de %5 artis saptanmis, 24 saat sonra ise bazal degerlere gore Hct’de artis yerine EP duzeyinde %25 yukselme gorulmustur. Bu ters gibi gorunen sonucun nedeni volum azalmasina bagli RAS’in aktive olmasidir.
Hct’ini %30’un uzerinde tutabilen hemodiyaliz hastalarinda, distan eritropoietine gerek duyanlara oranla plazma renin aktivitesinin yuksek oldugu belirlenmistir. Hiporeninemik hipoaldosteronizmi olan Tip I diabetiklerde anemi saptanmistir. ACE inhibitoru alan diabetik hastalarin kontrole gore Hb duzeylerinin dusuk oldugu izlenmistir. Her iki grupta da EP duzeyinin dusuk oldugu saptanmistir.
Bu bulgular klasik EP-Hct anlayisimizi genisletmistir. Kanama durumunda RAS aktivasyonu ile su ve tuz retansiyonu ile es zamanli olarak eritrosit yapimi da uyarilacaktir. Oysa eski bilgilerle hemorajide ancak su ve tuz tutulumu ile Hct degeri dustukten sonra EP uretimi artiyor ve bundan sonra eritrosit yapimi stimule oluyor diye dusunmemiz gerekecekti.