Genellikle zehirlenme nedeni olarak bilinen karbonmonoksit (CO) artık medikal gazlardan biri olarak da dikkatleri üzerine toplamakta. Hava kirliliğinin parçası olarak küçük dozlarda sürekli aldığımız CO, sigara içicilerinin daha yoğun şekilde inhale ettiği bir gaz. Hemoglobine (Hb) afinitesi pH=7.45’de oksijene göre 245 kat fazla. Hb’e bağlanarak molekülün oksijen taşıma kapasitesini etkilediğinden, CO yüksek dozlarda alındığında zehirleyici etki gösterirken, düşük dozlarda ise doku hasarına karşı koruyucu etki göstermesi, bu gazı ilginç hale getirmekte. CO Hb’in oksijen taşıma kapasitesini iki yolla etkilemekte: oksijene bağlanmasını birincisi kompetitif olarak inhibe ediyor; ikincisi ise Hb’de yapısal değişiklik yaparak dokuya oksijeni vermesini zorlaştırıyor (oksi-Hb dissosiasyon eğrisi sola kayarak dokunun oksijen ekstraksiyonu azalıyor). Ayrıca CO redükte sitokrom a3’ü bağlayıp inaktive ederek hücresel solunumu bozuyor.
CO inhalasyonunun doku hasarını azaltıcı etkisi kalpteki iskemi-reperfüzyon hasarında ve böbrekteki endotoksin hasarında gösterildi. Benzer şekilde akciğerde oluşan çeşitli etmenlere bağlı hasarda (hiperoksi, bleomisin ve ventilatöre bağlı pulmoner doku hasarı) CO’in koruyucu etkisi olduğuna dair kanıtlar artmakta.
İşin ilginç yanı memeli hücrelerinin CO’i kendilerini korumak amacıyla zaten kullanagelmekte olması. Hem-oksijenaz enziminin katalize ettiği bir reaksiyonla hem katabolizması sırasında CO vücutta endojen yolla üretilmekte.
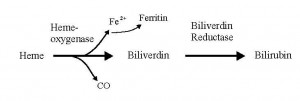
CO’in organizmamızda üretildiği ta 1963’de Coburn tarafından saptanmış olsa da bunun önemi yakın zamanlara dek anlaşılamamıştı. CO’nun vazodilatasyon, bronkodilatasyon, düz kas hücrelerinde proliferasyonu azaltma, santral ve periferik nörotraansmisyonda rol alma, pro- veya antiapoptotik, antiinflamatuar etki ve trombosit aggregasyonunu inhibe etme gibi özellikleri olduğu artık biliniyor.
Gözler günümüzde doğal koruyucu CO’in eksojen yolla verildiğinde gösterebileceği
sitoprotektif etkiye çevrilmiş durumda.
Anesthesiology 2008’de Goebel’in bir hayvan çalışması ve
editörün CO üzerine bir yazısı yayınlandı: Çalışma sonuçları, domuzda kardiyopulmoner bypass (KPB) modelinde belirgin hemodinamik etkiye neden olmaksızın CO inhalasyonunun potent antiinflamatuar ve akciğer koruyucu etkisini ortaya koymuş.
KPB’a bağlı oluşan akut akciğer hasarı açısından bakıldığında elde edilen sonuçlar önem taşıyor, zira bu patolojinin
sıklığı %1-3 olsa da
mortalitesi %50’ye ulaşmakta. Oksijenasyon indeksinde azalma, ventilasyon-perfüzyon dengesizliği, akciğer kompliyansında azalma gibi bulgularla seyreden hafif formlarının görülme sıklığı ise %12. Aslında problemsiz bir KPB sonrasında bile eğer pulmoner hasarı gösteren duyarlı incelemeler (protein akümülasayon indeksi, bronkoalveolar lavaj nötrofili, miyeloperoksidaz düzeyleri) yapılırsa akciğerlerde doku hasarı gösterilebilmekte. Kalp cerrahisi sonrası erken pulmoner disfonksiyon renal, nörolojik ve infeksiyöz komplikasyonlar nedeniyle morbidite ve mortaliteyi arttırıyor; mekanik ventilasyon süresinin uzaması yoğun bakım ve hastanede kalma süresini uzatıyor.
Goebel’in çalışması indüksiyondan sonra başlayarak 250 ppm CO inhale ettirilen hayvanlarda
proinflamatuardan antiinflamatuar sitokin dengesine doğru bir kayma olduğunu göstermiş: akciğer doku messenger-RNA ve proinflamatuar sitokinlerin (TNF, interlökin-1) protein konsantrasyonları azalırken, antiinflamatuar sitokin (interlökin-10) artmış. Bu sonuçlar aynı zamanda KPB’a inflamatuar yanıtta sitokinlerin rolünü göstermesi açısından da önemli. Çalışma sonuçlarına göre CO aynı zamanda apoptotik hücre ölümünün göstergesi olan kaspaz-3 aktivitesini ve pulmoner hasarın histolojik bulgularını da azaltmış. Ancak bu etkilere rağmen oksijenasyon gibi bir takım fizyolojik göstergeleri iyileştirmediği de çalışmanın bulguları arasında. Bu sonuçları destekler nitelikte olması açısından
Melley’in çalışması da ilginç: KPB sorası yeterli endojen CO üretmeyen hastalarda mortalitenin arttığı saptanmış.
CO nasıl organ protektif etki sağlıyor?
Çalışmalar antiinflamatuar, antioksidatif, antiproliferatif ve antiapoptotik etkilerini göstermiş, ama tam hücresel mekanizma hala araştırma konusu. Bu açıdan bakıldığında KPB öncesi uygulanan CO’in doku hasarını azaltıcı etkinliği “preconditioning” (önkoşullandırma) mediyatörlerini uyardığı yönündeki görüşü desteklemekte. Anestetik “preconditioning” kalp ve akciğerde iskemi-reperfüzyon hasarını azaltmakta. CO’in elektron transport zinciri enzimlerini inhibe ettiği ve
mitokondriyal reaktif oksijen radikallerinin oluşumunu azalttığı bildirilmekte.
CO inhalasyonu güvenli mi?
Goebel’in çalışmasında kullandığı 250 ppm CO 1 saat sonra karboksi-Hb düzeyini %11’e yükseltmiş; düzey KPB sonlandırıldıktan 4 saat sonra %5.6’ya gerilemiş. Aslında bu düzeyler doku hipoksisi ve organ hasarı için potansiyel riski arttırmakta. Ancak çalışmacılar standart laboratuar testlerinde karaciğer, kalp ve böbrek hasarını gösterebilecek sonuçlar saptamadıklarını bildirmişler. Tabi standart testler hafif dereceli hasarı göstermek için yeterli duyarlılığa da sahip olmayabilirler. Ayrıca deney süresinin kısalığı da dikkate alınmalı.
Her ne kadar CO’e kronik maruz kalmak akciğere zarar vermese de kardiyovasküler sisteme etkisi olmakta. Örneğin sıçanlarda miyokardiyal hipertrofi yaptığı; iskemik kalp hastalığı olan gönüllülerde kısa süreli, inhalasyonun fonksiyonel kapasiteyi belirgin düşürdüğü ve ST-segment değişiklikleri ile efor anginasına yol açtığı daha önceki çalışmalarda gösterilmiş. Genç, sağlıklı gönüllülerde zararlı ya da yararlı etkisi gösterilememiş olan CO’in yaşlı ve yandaş hastalığı olan hastalarda da aynı etkiyi göstereceği beklenmemeli. Halen akut respiratuar distres sendromu, kronik obstrüktif akciğer hastalığı ve böbrek transplantasyonu gibi çeşitli klinik problemlerde CO’in etkinliği konusunda çalışmalar sürmekte. Somut ve olumlu veriler toplandıkça sanırım yakın gelecekte CO klinik kullanımımıza girecek.
